题目内容
【题目】丁基锂((C4H9Li)是橡胶合成工业中一种常用的白色粉末试剂。熔点-95℃,沸点80℃,遇水、空气均易自燃,相对分之质量是64。下列关于丁基锂的说法正确的是
A. 丁基锂是由4个碳原子、9个氢原子、1个锂原子构成的
B. 丁基锂中碳元索质量分数为75%
C. 丁基锂运输或使用过程中如果发生燃烧,可以用水浇灭
D. 丁基锂是有机高分子化合物
【答案】B
【解析】
A. 丁基锂是由分子构成的,不是由原子构成的,一个丁基锂分子由是由4个碳原子、9个氢原子、1个锂原子构成的,此选项错误;
B. 丁基锂中碳元索质量分数为:![]() ×100%=75%,此选项正确;
×100%=75%,此选项正确;
C. 丁基锂遇水易自燃,在运输或使用过程中如果发生燃烧,不能用水浇灭,此选项错误;
D. 有机高分子化合物是指相对分子质量是几万、几十万,甚至高达几百万或更高的有机物,丁基锂不是有机高分子化合物,此选项错误。故选B。

 小题狂做系列答案
小题狂做系列答案【题目】如图是测定某赤铁矿粉中Fe2O3质量分数的实验装置:
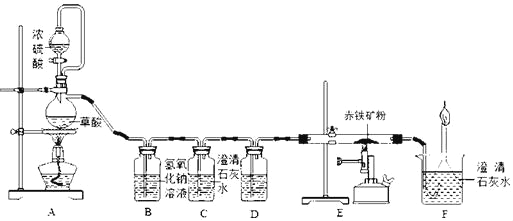
(1)A装置的作用是制取一氧化碳,反应的化学方程式为H2C2O4 =CO2↑+CO↑+H2O.根据反应装置判断,化学方程式中还缺少的条件是_____。
(2)C装置的作用是_____,D装置中药品的名称是_____,E装置中发生反应的化学方程式为_____,F处将尾气燃烧掉的目的是_____。
(3)实验过程中应该先点燃A处还是E处的加热装置?_____。
(4)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为_____。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
71.8g | 81.8g | 79.4克 |
(5)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?说出你的观点和理由是_____。
【题目】小金为探究铁制品锈蚀的条件,进行如下实验:
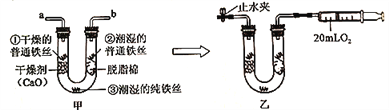
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。
观察对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是_______。
(2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。
【题目】下表为氯化钠、碳酸钠在水中的溶解度。我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱.夏天晒盐”获得大量湖盐。这里的“碱”指纯碱(主要成分是碳酸钠) ,盐指氯化钠。
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度 | 氯化钠 | 35.7 | 35.8 | 35.9 | 36.1 | 37.1 |
碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 | |
(1)请据图表简要解释“冬天捞碱,夏天晒盐”其中的道理____。
(2)小勤同学取该湖盐样品进行探究。
(提出问题)该湖盐样品的成分是什么?
(猜想与假设)猜想一:只有Na2CO3:猜想二:只有NaCl;猜想三:Na2CO3和NaCl。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量样品于试管中,向其中加入足量的____溶液;过滤,得沉淀和滤液,向沉淀中加入足量稀硝酸 | 产生白色沉淀 部分白色沉淀消失 | 猜想三成立 |
(拓展延伸)为进一步确定该湖盐样品中Na2CO3的质量分数,小勤同学再取该湖盐样品10.00g做了如图所示的补充实验(假定每步均完全反应或吸收)。
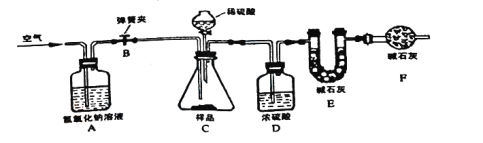
①反应结束之后通入足量空气的目的是_____。
②装置A中氢氧化钠溶液的作用是_____(用化学方程式表示)。
③实验结束后测得装置E增重0.44g,请根据上图所示的实验过程和提供的数据计算该湖盐样品中碳酸钠的质量分数是多少_____?(写出计算步骤,计算结果精确到0.1%)