��Ŀ����
����Ŀ����һ����ɫ���壬���ܺ���̼��ơ�����ͭ���Ȼ��ơ������ơ��Ȼ����е�һ�ֻ��֡�Ϊȷ������ɣ�����������ʵ�顣��֪���Ȼ�������������ҺΪ���ԡ�
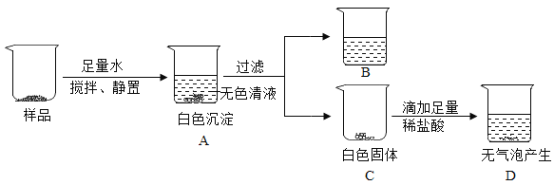
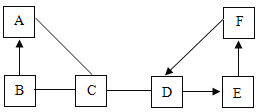
�ٰ�ɫ�����в�����CuSO4��������______��
�ڸ���C��D�����Ƴ���ɫ������һ��û��______��
���ձ�B����Һ��һ������______��������______(���û�ѧ����ʽ��ʾ)��
�����ʵ��̽��B��Һ�п��ܺ��еijɷ֣�ʵ�鲽�����£�
����Һ��pH
��ȡ������������Na2SO4��Һ
����ȡ������������Ba(NO3)2��Һ
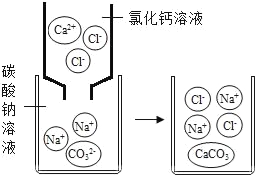
������������ַ�Ӧ��ȡ��Һ���Թ��У�����AgNO3��Һ
����ʵ�鲽��û��Ҫ������______��
���ۣ������ɫ����һ����______��
���𰸡�A���ϲ���ҺΪ��ɫ ̼��� �Ȼ��� ![]() ��͢� ���������Ȼ���
��͢� ���������Ȼ���
��������
��������ͭ����Һ������ɫ��̼���������ˮ�������ᷴӦ���ɶ�����̼���壬�����ƺ��Ȼ�����Ӧ�����ɲ�����������ᱵ��������ȡ����Ʒ����ˮ������ɫ��Һ��˵�������ڳ���������ɫ�����ʣ���˲��ܺ�������ͭ������Ϊ��ɫ�����μ�ϡ�������������ɣ�����̼��ƣ�
��Ϊ��������ij��������ᱵ���Ȼ�����������������û�������ӣ�����ֻ�������ᱵ���������Ժ��������ƺ��Ȼ�����
�ٰ�ɫ�����в�����CuSO4��������A���ϲ���ҺΪ��ɫ��
�ڸ���C��D�����Ƴ���ɫ������һ��û��̼��ơ�
���ձ�B����Һ��һ�������Ȼ��ƣ����������������Ȼ�����Ӧ���ɰ�ɫ�������ᱵ���Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
�����ʵ��̽��B��Һ�п��ܺ��еijɷ֣�ʵ�鲽�����£�
��ȡ������������Na2SO4��Һ����֤�Ƿ����Ȼ�����
����ȡ������������Ba(NO3)2��Һ����֤�Ƿ��������ƣ�
��Ϊ���Ȼ�������������ҺΪ���������ʲ���Һ��pH�������壻���ձ�B����Һ��һ�������Ȼ��ƣ����������������Ȼ�����Ӧ���ɰ�ɫ�������ᱵ���Ȼ��ƣ�û��Ҫ������
������ʵ�鲽��û��Ҫ�����Ǣ�͢���
���ۣ������ɫ����һ�������������Ȼ�����

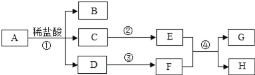
 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�