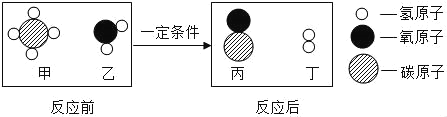
题目内容
【题目】向m g Zn和Fe的混合物中加入一定质量的Cu(NO3)2溶液,充分反应后过滤,将滤渣洗涤、干燥后称量,质量仍为m g。
(1)请分析滤液中一定含有哪些溶质?___________________________
(2)请写出导致析出固体质量减少的有关反应的化学方程式。__________________
【答案】Zn(NO3)2和Fe(NO3)2 Zn+Cu(NO3)2=Zn (NO3)2+Cu
【解析】
充分反应后过滤,将滤渣洗涤、干燥后称量,质量仍为mg,说明锌已经完全反应,铁参加反应生成了氯化亚铁,因此滤液颜色一定不是无色的,因为锌和铁都与氯化铜发生了反应,因此滤液中一定有Zn(NO3)2和Fe(NO3)2;
锌、铁和硝酸铜反应的化学方程式及其质量关系为:
![]() ,
,![]() ,
,
由以上质量关系可知,每65份质量的锌和硝酸铜反应生成64份质量的铜,导致反应前后固体质量减小,每56份质量的铁和硝酸铜反应生成64份质量的铜,导致反应前后固体质量增大,所以 导致析出固体质量减少的有关反应的化学方程式为:Zn+Cu(NO3)2=Zn (NO3)2+Cu。

练习册系列答案
相关题目