题目内容
取一定量Fe2O3与Al2O3的混合物,加入含溶质9.8g的稀硫酸,恰好完全反应.原混合物中氧元素的质量是( )
| A.0.8g | B.1.6g | C.3.2g | D.6.4g |
B
解析试题分析:氧化铁和氧化铝与稀硫酸反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,:Al2O3+3H2SO4═Al2(SO4)3+3H2O由于氧化铝和氧化铁的混合物与9.8g硫酸恰好完全反应,分析化学方程式可以知道硫酸根中氧元素没有发生改变,依然在硫酸根中,而氧化铝和氧化铁中的氧元素则转变为水中的氧元素,即混合物中氧元素的质量和水中氧元素的质量相等,由方程式可得硫酸与水的关系式为H2SO4~H2O,设生成水的质量为x,则
H2SO4~H2O
98 18
9.8g x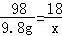
x=1.8g
所以水中氧元素的质量为:1.8g×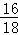 =1.6g.分析所给的选项可以知道选项B是正确的.
=1.6g.分析所给的选项可以知道选项B是正确的.
考点:根据化学反应方程式的计算.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
20 ℃时,向100 g质量分数为 26.5%的饱和氯化钠溶液中加入 3.5 g氯化钠,此时溶液中溶质的质量分数为( )
| A.26.5% | B.30% | C.25% | D. |
如图,表示镁、铜与其氧化物的质量关系。图线不重合的原因是 ( )
| A.镁和铜的密度不同 |
| B.与等质量的镁和铜化合的氧元素质量不同 |
| C.加热不充分,没有完全氧化 |
| D.实验的误差造成 |
某钢样品的含碳量为0.6%(杂质元素不考虑),若碳元素主要以Fe2C和Fe3C的形式存在,则该钢样品中Fe2C和Fe3C的质量分数(ω)范围是( )
| A.0.03%<ω<2% | B.0.6%<ω<0.87% |
| C.2.48%<ω<3.6% | D.6.2%<ω<9% |
点燃H2、O2和N2的混合气体20g,充分反应后生成18g水,则剩余的可能是( )
| A.O2和N2的混合气体2g | B.H2和N2的混合气体2g |
| C.H2、O2和N2的混合气体2g | D.2g N2 |
某NaOH固体样品已部分变质。常温下,取61.2g该样品溶于水得到1000g溶液,取出500g溶液进行测定,其中含Na元素16.1g,碳元素1.2g,则原NaOH固体样品中NaOH的质量分数为
| A.65.4% | B.34.6% | C.82.3% | D.64.5% |