题目内容
某NaOH固体样品已部分变质。常温下,取61.2g该样品溶于水得到1000g溶液,取出500g溶液进行测定,其中含Na元素16.1g,碳元素1.2g,则原NaOH固体样品中NaOH的质量分数为
| A.65.4% | B.34.6% | C.82.3% | D.64.5% |
A
解析试题分析:氢氧化钠部分变质是由于部分氢氧化钠和空气中的二氧化碳反应生成了碳酸钠,利用碳酸钠化学式中碳和钠的质量比,根据碳元素质量可求出钠元素的质量。然后用钠元素的总质量减去碳酸钠中钠元素的质量,就得到氢氧化钠中钠元素的质量,然后求出氢氧化钠的质量,最后进一步求出氢氧化钠的质量分数。 解:设Na2CO3中钠元素的质量为x
根据Na2CO3中碳元素和钠元素的质量比可得: 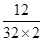 =
=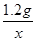
解得x=4.6g
所以氢氧化钠中钠元素的质量为16.1g﹣4.6g=11.5g
根据NaOH的化学式可得NaOH中钠元素的质量分数为: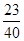 ×100%=57.5%
×100%=57.5%
所以氢氧化钠的质量为: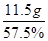 =20g
=20g
这是500g溶液中所含氢氧化钠的质量,那么在1000g溶液中含有的氢氧化钠应该为40g
因此原固体样品中氢氧化钠的质量分数为: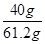 ×100%=65.4%
×100%=65.4%
所以答案选A
考点:考查化学反应方程式的计算;元素质量比的计算;元素的质量分数计算

已知某CO和02的混合气体中,碳元素、氧元素的质量比为1:4,现取12g该混合气体在密闭容器中点燃,充分反应后,生成二氧化碳的质量为
| A.3.8g | B.8.8g | C.12g | D.13.2g. |
取一定量Fe2O3与Al2O3的混合物,加入含溶质9.8g的稀硫酸,恰好完全反应.原混合物中氧元素的质量是( )
| A.0.8g | B.1.6g | C.3.2g | D.6.4g |
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如表所示:
| | 甲 | 乙 | 丙 |
| 金属混合物质量/g | 10 | 10 | 20 |
| 稀硫酸质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲同学所得溶液中含有的溶质是 .
(2)计算丙同学所得溶液中溶质的质量分数.(计算结果精确到0.1%)
一定质量的镁条在氧气中完全燃烧后生成氧化镁.固体质量随时间的变化关系如图所示.下列说法不正确的是( )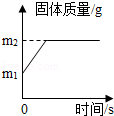
| A.生成MgO的质量:m2g |
| B.参加反应的Mg的质量:m1 g |
| C.参加反应的O2的质量:(m2﹣m1)g |
D.参加反应的镁和氧气的质量比=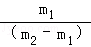 |
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
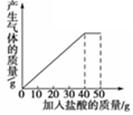
请计算:
(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.
将80 g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
| A.80 g | B.100 g | C.200 g | D.280 g |
某碳酸钾溶液中,碳酸根与水分子数之比为1:100,向该溶液中通入足量二氧化碳,碳酸钾跟水和二氧化碳反应全部转变为碳酸氢钾,此碳酸氢钾溶液的溶质质量分数为
| A.5.26% | B.5.56% | C.7.13% | D.10.0% |