题目内容
【题目】一定条件下,某反应前后各物质的质量如下表所示。下列判断不正确的是( )
物质的构成微粒 |
|
| M |
|
|
反应前的质量/g | 68 | 32 | 0 | 1 | |
t时刻的质量/g | 8 | x | |||
反应后的质量/g | 0 | 0 | y | 37 |
A.x=0.75y
B.物质M中一定不含氧元素
C.反应物的化学计量数之比为2:3
D.反应前后硫元素化合价发生改变
【答案】C
【解析】
由表可得,反应前H2S的质量为68g,反应后质量为0g,质量减少68g,为反应物,反应前O2的质量为32g,反应后质量为0g,质量减少32g,为反应物,反应前H2O的质量为1g,反应后的质量为37g,质量增多36g,为生成物,M反应前为0g,反应后为68g+32g+1g-37g=64g,为生成物;假设H2S前的化学计量系数为m,O2前的化学计量系数为n,则反应物的化学计量数之比为: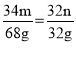 ,
,![]() ;根据质量守恒定律的微观实质:化学反应前后,原子个数和种类不变可知,反应前有:4H,反应后,因M中一定含有硫元素,所以,不能含有氢元素,因此,H2O前的化学计量系数为2,才能符合反应前后都4H,反应前后2O、2S,反应后:2H2O中有4H、2O,剩余的2S,属于另一生成物,故M前的化学计量系数为2,M的化学式为:S,最终得出该反应的化学方程式为:2H2S+O2
;根据质量守恒定律的微观实质:化学反应前后,原子个数和种类不变可知,反应前有:4H,反应后,因M中一定含有硫元素,所以,不能含有氢元素,因此,H2O前的化学计量系数为2,才能符合反应前后都4H,反应前后2O、2S,反应后:2H2O中有4H、2O,剩余的2S,属于另一生成物,故M前的化学计量系数为2,M的化学式为:S,最终得出该反应的化学方程式为:2H2S+O2![]() 2S+2H2O,据此思路进行解析。
2S+2H2O,据此思路进行解析。
A、由化学方程式:2H2S+O2![]() 2S+2H2O的意义可得,当消耗32g氧气时,生成64g硫,即y=64g,由表可知,t时刻,剩余氧气质量为8g,即参加反应的氧气质量为32g-8g=24g,当参加反应的氧气质量为24g时,假设生成硫的质量为x,根据各物质实际质量比=各物质相对分子质量总量比可得,
2S+2H2O的意义可得,当消耗32g氧气时,生成64g硫,即y=64g,由表可知,t时刻,剩余氧气质量为8g,即参加反应的氧气质量为32g-8g=24g,当参加反应的氧气质量为24g时,假设生成硫的质量为x,根据各物质实际质量比=各物质相对分子质量总量比可得,![]() ,则x=48g,因此,x=0.75y,选项说法正确,故不符合题意;
,则x=48g,因此,x=0.75y,选项说法正确,故不符合题意;
B、由化学方程式可知,物质M中一定不含氧元素,选项说法正确,故不符合题意;
C、由分析可知,反应物的化学计量数之比为1:2,选项说法错误,故不符合题意;
D、由化学方程式可知,反应前H2S中硫元素的化合价为:-2,反应后S的化合价为:0,反应前后硫元素化合价发生改变,选项说法正确,故不符合题意。

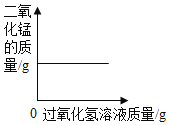
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D