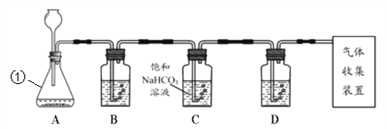
题目内容
【题目】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯 ZnO,其部分工艺流程如图所示。请回答:
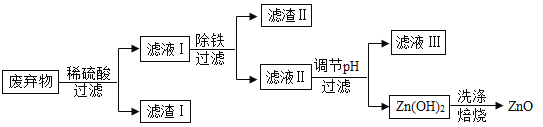
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)要验证Zn、Fe、Cu三种金属的活动性顺序,下列方法正确的是_____(填写序号),
A将Zn和Cu分别加入到FeSO4溶液中
B将Fe分别加入到ZnSO4溶液和CuSO4溶液中
C将Zn分别加入到FeSO4、CuSO4
D将三种形状、大小相同的金属分别投入到相同溶质质量分数的稀硫酸中
(2)加酸溶解废弃物时,需要通风并远离火源,此过程中 Zn 还能起到除铜作用,除铜的化学方程式为_____,此反应属_____(填基本反应类型),滤渣 I 的组成中一定有_____。
(3)调节pH 可用NaOH,但不能过量,其原因是_____。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为_____。
【答案】ABD ![]() 置换反应 铜 Zn(OH)2 溶于强碱形成可溶性盐
置换反应 铜 Zn(OH)2 溶于强碱形成可溶性盐 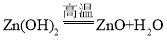
【解析】
(1)A、将Zn和Cu分别加入到FeSO4溶液中,锌表面析出黑色固体,是因为锌和硫酸亚铁反应生成硫酸锌和铁,说明锌比铁活泼,铜表面无明显现象,说明铜不能和硫酸亚铁反应,即铁比铜活泼,符合题意;
B、将Fe分别加入到ZnSO4溶液和CuSO4溶液中,铁表面分别无明显现象、析出红色固体,是因为铁不能和硫酸锌反应、和硫酸铜反应生成硫酸亚铁和铜,说明铁不如锌活泼,比铜活泼,符合题意;
C、将Zn分别加入到FeSO4、CuSO4中,锌表面分别析出黑色固体、红色固体,说明锌能和硫酸亚铁、硫酸铜反应,即锌最活泼,不能判断铁和铜的活泼性,不符合题意;
D、将三种形状、大小相同的金属分别投入到相同溶质质量分数的稀硫酸中,锌表面产生气泡比铁快,说明锌比铁活泼,铜表面无明显现象,说明铜最不活泼,符合题意。
故选ABD。
(2)加酸溶解废弃物时,需要通风并远离火源,此过程中 Zn 还能起到除铜作用,是因为锌能和硫酸铜反应生成硫酸锌和铜,除铜的化学方程式:![]() ;
;
该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,是置换反应;
锌、铁能与稀硫酸反应,铜与稀硫酸不反应,故滤渣 I 的组成中一定有铜;
(3)调节pH 可用NaOH,但不能过量,其原因是Zn(OH)2 溶于强碱形成可溶性盐。
故填:Zn(OH)2 溶于强碱形成可溶性盐。
(4)焙烧Zn(OH)2发生分解反应生成氧化锌和水,该反应的化学方程式为: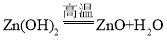 。
。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】一定条件下,某反应前后各物质的质量如下表所示。下列判断不正确的是( )
物质的构成微粒 |
|
| M |
|
|
反应前的质量/g | 68 | 32 | 0 | 1 | |
t时刻的质量/g | 8 | x | |||
反应后的质量/g | 0 | 0 | y | 37 |
A.x=0.75y
B.物质M中一定不含氧元素
C.反应物的化学计量数之比为2:3
D.反应前后硫元素化合价发生改变