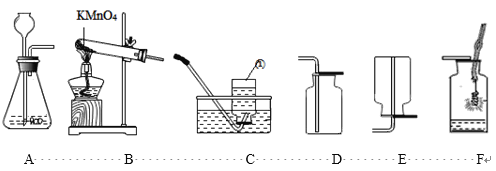
题目内容
【题目】我国首个大型页岩气田涪陵页岩气田累计供气突破100亿方。页岩气是从页岩层中开采出来的天然气,是一种重要的非常规天然气资源,被誉为未来能源的“明星”。
(1)页岩气与天然气的主要成分都是甲烷(化学式为CH4),甲烷是一种最简单的____(填“有机”或“无机”)化合物,甲烷中碳、氢元素之间的最简质量比为____,碳元素质量分数为____。
(2)页岩气主要成分在空气中完全燃烧的化学方程式为____。甲烷燃烧所需要的条件是与氧气接触和____。
(3)甲烷在燃烧时能量转化形式主要是化学能转化为____能。甲烷在空气中不完全燃烧的化学方程式为3CH4+5O2![]() CO2+2CO+6H2O,所造成环境污染的原因是______。
CO2+2CO+6H2O,所造成环境污染的原因是______。
【答案】有机 3:1 75% CH4+2O2 ![]() CO2+2H2O 温度达到着火点 热(或内) 不完全燃烧生成的一氧化碳有毒,会污染空气等
CO2+2H2O 温度达到着火点 热(或内) 不完全燃烧生成的一氧化碳有毒,会污染空气等
【解析】
(1)页岩气与天然气的主要成分都是甲烷(化学式为CH4),甲烷中含有碳元素和氢元素,是一种最简单的有机化合物,甲烷中碳、氢元素之间的最简质量比为12:(14)=3:1;碳元素质量分数为=![]() ;
;
(2)页岩气主要成分是甲烷,甲烷在空气中完全燃烧产生水和二氧化碳的化学方程式为:CH4+2O2 ![]() CO2+2H2O。甲烷燃烧所需要的条件是与氧气接触和温度达到着火点;
CO2+2H2O。甲烷燃烧所需要的条件是与氧气接触和温度达到着火点;
(3)甲烷在燃烧时能量转化形式主要是化学能转化为热能。甲烷在空气中不完全燃烧的化学方程式为3CH4+5O2![]() CO2+2CO+6H2O,一氧化碳有毒,所造成环境污染的原因是:不完全燃烧生成的一氧化碳有毒,会污染空气等;
CO2+2CO+6H2O,一氧化碳有毒,所造成环境污染的原因是:不完全燃烧生成的一氧化碳有毒,会污染空气等;

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】文献资料表明,某些金属与酸反应存在氯离子效应,即氯离子的存在能加快其反应速率。
(1)某化学小组为了探究氯离子效应,在室温下,进行了如下实验。
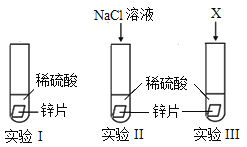
记录现象:实验II比实验I产生气泡快。
①实验I主要目的是_____,写出实验I中反应的化学方程式:_____。
②为了说明实验II中反应速率加快是氯离子效应,实验III中X是_____(填标号)。
a.Na2SO4溶液 b.Na2CO3溶液 c.NaOH溶液 d.H2O
③上述三个实验还应控制相同的条件是:_____(写两点)。
(2)为了进一步探究温度和氯离子对反应速率的影响,化学小组又在不同温度下进行了两组实验,数据如下表所示(表中“所用时间”是指锌与稀硫酸反应生成15mL氢气所用的时间)。
序号 | 温度环境(℃) | 未加入氯化钠所用时间(s) | 加入氯化钠所用时间(s) |
1 | 27 | 63 | 32 |
2 | 37 | 59 | 21 |
3 | 47 | 36 | 18 |
4 | 57 | 22 | 11 |
5 | 67 | 15 | 10 |
6 | 77 | t | 8 |
④表中数据可得出:温度升高,锌与稀硫酸的反应速率_____(填“变大”或“变小”)。
⑤表中t的数值范围是_____。
⑥由表中数据可知:温度升高,锌与稀硫酸反应的氯离子效应减弱,可能的原因是:_____。