题目内容
【题目】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5 mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
实验序号 | 滴加CuSO4 溶液的量 | 实验现象 |
① | 第1~6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多。振荡后沉淀不消失,很快沉淀逐渐变成黑色 |
已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式_____________。
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下稳定,70 ℃~80 ℃时分解生成氧化铜。
Ⅱ.铜酸钠[Na2Cu(OH)4]溶液呈亮蓝色。
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应。
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液。
甲同学认为猜想Ⅰ不成立,理由是______________________________。
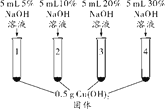
乙同学为验证猜想Ⅱ,进行了如下实验。
【进行实验】
实验操作 |
|
实验现象 | |
1号试管,…… | |
2号试管,蓝色固体不消失 | |
3号试管,蓝色固体减少 | |
4号试管,蓝色固体消失,得到亮蓝色溶液 |
【解释与结论】
(1)1号试管中现象为_________________________________。
(2)上述实验得出的结论是__________________________。
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为__________________________。
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是____________________________。
【答案】 CuSO4+2NaOH=== Na2SO4+Cu(OH)2↓ 氢氧化铜分解生成黑色的氧化铜固体 蓝色固体不消失 氢氧化铜能溶解在浓度高于20%的NaOH溶液中,并形成亮蓝色溶液 2NaOH+Cu(OH)2=== Na2Cu(OH)4 蓝色沉淀逐渐变为黑色
【解析】根据硫酸铜和氢氧化钠反应产生氢氧化铜蓝色沉淀和硫酸钠,写出反应的方程式;【猜想与假设】根据实验①的现象是沉淀消失,形成亮蓝色溶液,而不是产生黑色固体分析;【解释与结论】(1)根据随着氢氧化钠溶液的浓度增大而氢氧化铜不断溶解分析解答;(2)根据实验现象分析,得出实验结论进行解答;【反思与评价】(1)根据信息写出反应的化学方程式;(2)根据现象及资料信息分析能量变化。硫酸铜和氢氧化钠反应产生氢氧化铜蓝色沉淀和硫酸钠,故反应的方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;【猜想与假设】根据实验①的现象是沉淀消失,形成亮蓝色溶液,而不是产生黑色固体,甲同学认为猜想Ⅰ不成立,理由是氢氧化铜分解生成黑色的氧化铜固体;【解释与结论】(1) 随着氢氧化钠溶液的浓度增大而氢氧化铜不断溶解,所以1号试管中现象为蓝色固体不消失;(2)由实验现象可以知道,氢氧化铜能溶解在浓度高于20%的NaOH溶液中,并形成亮蓝色溶液;【反思与评价】(1)氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4;(2) 氢氧化铜在室温下稳定,70 ℃~80 ℃时分解生成氧化铜,因此说明饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案