题目内容
【题目】根据如图实验回答问题。
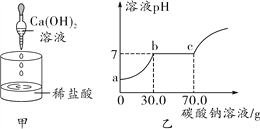
取甲反应后的溶液,滴加Na2CO3溶液,溶液pH的变化如图乙所示,则b点的含义是___________,与CaCl2反应的碳酸钠溶液的质量为________g。
【答案】 所加的碳酸钠与稀盐酸恰好完全反应,溶液呈中性(合理即可) 40
【解析】根据题目的信息可知,pH变化情况溶液最初pH<7,所以甲反应后的溶液中一定含CaCl2和HCl,逐滴加入Na2CO3溶液,图乙可以判断是盐酸先反应,因此PH值逐渐增大到7,氯化钙再与碳酸钠反应PH=7,到c点之后碳酸钠过量。溶液pH的变化图乙可知ab段是碳酸钠与盐酸反应,bc段是碳酸钠与氯化钙反应,c点之后碳酸钠过量;所以b点的含义是所加的碳酸钠与盐酸恰好反应,溶液呈中性,与CaCl2反应的碳酸钠溶液的质量为70.0g-30.0g=40.0g。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5 mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
实验序号 | 滴加CuSO4 溶液的量 | 实验现象 |
① | 第1~6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多。振荡后沉淀不消失,很快沉淀逐渐变成黑色 |
已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式_____________。
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下稳定,70 ℃~80 ℃时分解生成氧化铜。
Ⅱ.铜酸钠[Na2Cu(OH)4]溶液呈亮蓝色。
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应。
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液。
甲同学认为猜想Ⅰ不成立,理由是______________________________。
乙同学为验证猜想Ⅱ,进行了如下实验。
【进行实验】
实验操作 |
|
实验现象 | |
1号试管,…… | |
2号试管,蓝色固体不消失 | |
3号试管,蓝色固体减少 | |
4号试管,蓝色固体消失,得到亮蓝色溶液 |
【解释与结论】
(1)1号试管中现象为_________________________________。
(2)上述实验得出的结论是__________________________。
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为__________________________。
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是____________________________。