题目内容
【题目】某化学兴趣小组在学习酸碱中和反应实验时,进行了如下探究:
I探究酸和碱能否发生反应
甲同学向盛有少量KOH溶液的试管中滴入几滴无色酚酞试液,振荡,继续加入稀盐酸,观察到溶液由_______色变成无色。甲同学得出结论:酸和碱能发生反应。
请写出稀盐酸和氢氧化钾溶液反应的化学方程式_____________。
Ⅱ探究酸和碱反应后溶液中溶质的成分
乙同学对探究I中甲同学实验后的无色溶液展开探究
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(提出猜想)(1)KCl;(2)KCl和__________(填化学式)。
(设计实验)
方案 | 实验操作 | 实验现象及方程式 | 实验结论 |
方案1 | 试管中加入少量碳酸钠,然后加入过量甲同学实验后的无色溶液 | 可观察到溶液中有_______产生,化学反应方程式为________。 | 猜想(2)成立 |
方案2 | 用玻璃棒蘸取少量反应后的溶液滴在PH试纸上 | pH________7(填“>“<”或“=”) | |
方案3 | 取少量实验后的无色溶液于试管中,然后慢慢加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现_______。 |
(发散思维)
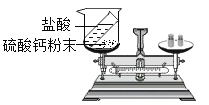
为了验证猜想(2)成立,你认为还可以选择的物质是_________(填选项)。
A二氧化碳 B锌粒 C氧化铜 D紫色石蕊试液
【答案】红 ![]() HC1 气泡
HC1 气泡 ![]() < 溶液由无色变为红色 BCD
< 溶液由无色变为红色 BCD
【解析】
I探究酸和碱能否发生反应
酚酞滴加到碱性溶液氢氧化钾中显红色,而加入盐酸后,盐酸与氢氧化钠反应,氢氧化钠被消耗,红色褪去,所以溶液由红色变为无色,反应方程式为![]() ;
;
Ⅱ探究酸和碱反应后溶液中溶质的成分
[提出猜想]盐酸中滴加酚酞溶液也为无色,因此滴加盐酸是否过量不能确定,所以猜想(1)是氢氧化钾与盐酸恰好反应,而在猜想(2)中可以考虑盐酸过量,此时盐酸与氢氧化钾反应后还有剩余,所以溶质中除了氯化钾还有剩余的盐酸,所以猜想(2)是KCl、HCl;
[实验设计]题目中给出实验结论是猜想(2)正确,则溶液中除酚酞外还有氯化钾和盐酸,以此回答,方案1中加入少量碳酸钠加入甲同学的实验后的溶液,溶液中有盐酸,盐酸与碳酸钠反应生成二氧化碳气体,则溶液中就有气泡生成,反应方程式为![]() ;
;
方案2中将1中反应后的溶液滴加到pH试纸上,测定溶液的pH值,在1中滴加液体了少量的碳酸钠,盐酸未被消耗完毕,剩余氯化钾和生成的氯化钠溶于水后都是中性溶液,所以测试pH值时,显示盐酸的酸性,酸性溶液的pH值应小于7,所以pH<7;
方案3中在1中反应后的溶液中滴加氢氧化钠溶液,开始时没有明显现象,说明盐酸有剩余,与氢氧化钠进行中和反应,当滴加氢氧化钠将盐酸全部消耗完毕后,继续滴加氢氧化钠,溶液显碱性,酚酞在碱性溶液中显红色,所以开始无明显现象,过一会发现溶液由无色变为红色;
[发散思维]验证猜想(2)正确,主要验证盐酸的存在:
A、二氧化碳与盐酸不发生反应,不能验证盐酸的存在,选项A不符合题意;
B、锌粒可以与盐酸反应,生成氢气,有气体生成,溶液可以观察到气泡,证明盐酸的存在,选项B符合题意;
C、氧化铜为黑色粉末,可以盐酸反应生成氯化铜和水,氯化铜溶液为蓝色,所以可以观察到黑色粉末溶解,生成蓝色溶液,证明盐酸的存在,选项B符合题意;
D、紫色石蕊溶液滴加酸性溶液后,溶液变为红色,所以可以通过观察溶液由无色变为红色,证明盐酸的存在,选项D符合题意。故选BCD。

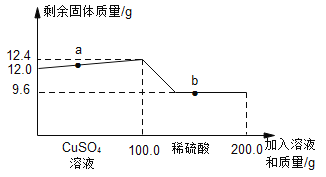
【题目】某实验小组的同学为了测定实验室中高锰酸钾样品的纯度,取20g该样品,依次加热该混合物,t1、t2、t3、t4时间后,称得剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 19.88 | 19.56 | 19.36 | 19.36 |
试计算:(1)加热__________时间后高锰酸钾已经完全反应。
(2)完全反应后产生氧气的质量为_________g。
(3)求该样品中高锰酸钾的质量分数_______。