题目内容
【题目】已知A、B、C、D、E、F六种物质间有如下的转变关系(发生的反应都是化合反应),其中A、B、C在通常情况下是三种无色无味的气体,且C为化合物,D是一种无色的液体氧化物,F是一种能使紫色石蕊试液变红的物质。
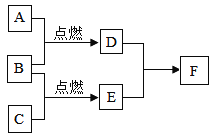
(1)请写出有关物质的化学式:A______ B______ C________D_______ E______F______
(2)写出下列变化的化学方程式:
A + B → D : __________________________________________
C + B → E : __________________________________________
D + E → F : __________________________________________
【答案】 H2 O2 CO H2O CO2 H2CO3 H2 + O2 ![]() 2H2O 2CO + O2
2H2O 2CO + O2 ![]() 2CO2 CO2 + H2O === H2CO3
2CO2 CO2 + H2O === H2CO3
【解析】(1)A、B、C在通常情况下是三种无色无味的气体,A、B点燃会生成D,B、C点燃会生成E,D是一种无色的液体氧化物,所以D是水,A是氢气,B是氧气,C是一氧化碳,一氧化碳燃烧会生成二氧化碳,所以E是二氧化碳,F是一种能使紫色石蕊试液变红的物质,二氧化碳和水生成碳酸,所以F是碳酸,所以A是H2,B是O2,C是CO,D是H2O,E是CO2,F是H2CO3;(2)A+B→D的反应是氢气和氧气在点燃俄条件下生成水,化学方程式为:2H2 + O2![]() 2H2O;C+B→E的反应是一氧化碳和氧气反应生成二氧化碳,化学方程式为:2CO + O2
2H2O;C+B→E的反应是一氧化碳和氧气反应生成二氧化碳,化学方程式为:2CO + O2![]() 2CO2;D + E → F的反应是水和二氧化碳反应生成碳酸,化学方程式为:CO2 + H2O =H2CO3。
2CO2;D + E → F的反应是水和二氧化碳反应生成碳酸,化学方程式为:CO2 + H2O =H2CO3。

【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
剩余固体质量/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0至t1时间段,固体质量不变的原因是____________________________。
(2)反应中产生氧气的质量是_________。
(3)求样品中高锰酸钾的质量分数_________。
(4)该反应中转化为氧气的氧元素质量占高锰酸钾中氧元素质量的________%。