题目内容
【题目】水是实验室中常用的物质,请说出下列实验中水的作用。
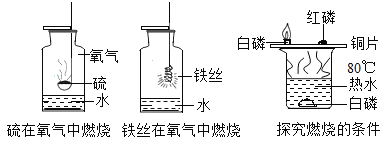
(1)________。
(2)______。
(3)_____(写一条即可)。
【答案】吸收有毒的生成物二氧化硫 防止高温熔融物溅落使瓶底炸裂 提供热量,使温度达到可燃物的着火点
【解析】
(1)硫在氧气中燃烧会生成有毒的大气污染物二氧化硫,而水可以吸收有毒的二氧化硫气体,防治污染空气。故答案为:吸收有毒的生成物二氧化硫;
(2)铁丝在纯氧中剧烈燃烧、火星四射、放出大量的热、生成黑色固体。在燃烧的过程中,生成的高温熔融物会溅落至瓶底,若没有水,则高温熔融物直接溅落到瓶底,会使玻璃仪器炸裂。故答案为:防止高温熔融物溅落使瓶底炸裂;
(3)水的温度约为80℃,则铜片上的白磷温度达到着火点会燃烧,而红磷由于温度没有达到着火点,则不会燃烧。水中的白磷虽然温度达到了着火点,但是由于没有接触氧气,也不会燃烧。所以水的作用是提供热量,使温度达到可燃物的着火点。故答案为:提供热量,使温度达到可燃物的着火点。

【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于氟元素的一条信息:_________。
(2) 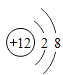 写出该结构简图的微粒符号_______。
写出该结构简图的微粒符号_______。
(3)第13号元素与第17号元素组成的化合物的化学式是 _______。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
A Be和Mg
B C和Ne
C Al和Si
D F和Cl
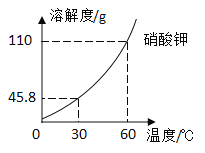
【题目】K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )
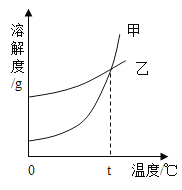
温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 117 | 121 | 126 | 139 |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100gKNO3饱和溶液中含63.9gKNO3
【题目】碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。
(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是______(填字母)。
a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
溶质质量分数 | 1% | 2% | 4% |
溶液pH | 11.62 | 11.76 | 11.90 |
分析I、Ⅱ、Ⅲ三组数据可得出的结论是________。
(制备物质)用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
(已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀)
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是______(填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:![]() ,则X的化学式为___________。
,则X的化学式为___________。
(标定浓度)标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数_____(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将_____(填“偏大”、“偏小”或“无影响”)。
【题目】生铁和钢都是铁和碳的合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数 | 加盐酸前 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量(g) | 0 | 20 | 20 | 20 | 20 | 20 |
锥形瓶内物质的总质量(g) | 11.5 | 31.4 | m | 71.2 | 91.1 | 111.1 |
(查阅资料)碳不与稀盐酸反应。
请回答下列问题:
(1)根据质量守恒定律,该反应中生成气体的总质量为 。
(2)实验数据表中m的值为 。
(3)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。