题目内容
我国海洋资源非常丰富,从海水得到的粗盐,往往含有可溶性杂质(主要有MgCl2,CaCl2,Na2SO4)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活,粗盐提纯的部分流程如图1:
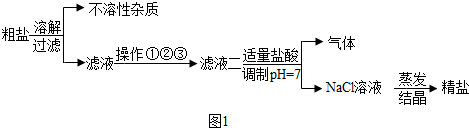
其中,滤液一至滤液二之间需进行三步操作:
①加入过量的碳酸钠,除去滤液中的CaCl2;
②加入过量的X,除去滤液中的MgCl2;
③加入过量的氯化钡,除去滤液中的Na2SO4
请回答:
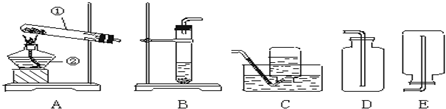
(1)在以上实验流程中,需要用到如图2所示的三项操作:

①根据粗盐提纯的部分流程图,三项操作的先后顺序为 (填字母顺序),在这三项操作中,均需用到的仪器是 ,其中在A操作中的作用是 ;②在B操作装置中,漏斗应如何放置 .
(2)操作中的物质X为 ,正确的操作顺序为 (填序号),为最终获得精盐,操作①、②和③后还需增加的操作是 ;
(3)滤液二中加入适量稀盐酸的目的是 ,写出产生气体的化学方程式 .

其中,滤液一至滤液二之间需进行三步操作:
①加入过量的碳酸钠,除去滤液中的CaCl2;
②加入过量的X,除去滤液中的MgCl2;
③加入过量的氯化钡,除去滤液中的Na2SO4
请回答:
(1)在以上实验流程中,需要用到如图2所示的三项操作:

①根据粗盐提纯的部分流程图,三项操作的先后顺序为
(2)操作中的物质X为
(3)滤液二中加入适量稀盐酸的目的是
考点:氯化钠与粗盐提纯,过滤的原理、方法及其应用,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:(1)根据粗盐提纯的操作步骤和操作过程中的注意事项解答;
(2)根据除杂质的注意事项:加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质;根据加入碳酸钠的目的来考虑实验顺序;
(3)根据实验中过量物质的处理方法和碳酸钠和稀盐酸反应生成氯化钠、水、二氧化碳考虑.
(2)根据除杂质的注意事项:加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质;根据加入碳酸钠的目的来考虑实验顺序;
(3)根据实验中过量物质的处理方法和碳酸钠和稀盐酸反应生成氯化钠、水、二氧化碳考虑.
解答:解:(1)①粗盐提纯的基本步骤是:溶解、过滤、蒸发;这三项操作都用到玻璃棒,在蒸发时玻璃棒的作用是搅拌使液体受热均匀,防止因局部温度过高造成液滴飞溅,A就是蒸发操作;
②B是过滤操作,过滤时漏斗管尖嘴紧靠烧杯内壁;
(2)除去镁离子是利用将镁离子沉淀出来除去,所以用氢氧根离子即可,又因为不能引入新的杂质最后得到的是氯化钠,所以阳离子是钠离子;所以X是氢氧化钠;加入碳酸钠的目的有两个:一是除去加入的过量的氯化钡,二是除去滤液中的Ca2+;所以碳酸钠必须放在氯化钡的后面,氢氧化钠可以在前面或者在后面;①、②和③产生了三种沉淀,所以将沉淀与滤液分离的方法是通过过滤的方法;
(3)由于加入的碳酸钠和氢氧化钠都是过量的,所以加入盐酸是为的与过量的碳酸钠和氢氧化钠反应.
故答案为:
(1)CBA;玻璃棒;搅拌使液体受热均匀,防止因局部温度过高造成液滴飞溅;使漏斗管尖嘴紧靠烧杯内壁;
(2)氢氧化钠溶液;③①②(或②③①或③②①);过滤;
(3)除掉过量的氢氧化钠和过量的碳酸钠;Na2CO3+2HCl=2NaCl+H2O+CO2↑.
②B是过滤操作,过滤时漏斗管尖嘴紧靠烧杯内壁;
(2)除去镁离子是利用将镁离子沉淀出来除去,所以用氢氧根离子即可,又因为不能引入新的杂质最后得到的是氯化钠,所以阳离子是钠离子;所以X是氢氧化钠;加入碳酸钠的目的有两个:一是除去加入的过量的氯化钡,二是除去滤液中的Ca2+;所以碳酸钠必须放在氯化钡的后面,氢氧化钠可以在前面或者在后面;①、②和③产生了三种沉淀,所以将沉淀与滤液分离的方法是通过过滤的方法;
(3)由于加入的碳酸钠和氢氧化钠都是过量的,所以加入盐酸是为的与过量的碳酸钠和氢氧化钠反应.
故答案为:
(1)CBA;玻璃棒;搅拌使液体受热均匀,防止因局部温度过高造成液滴飞溅;使漏斗管尖嘴紧靠烧杯内壁;
(2)氢氧化钠溶液;③①②(或②③①或③②①);过滤;
(3)除掉过量的氢氧化钠和过量的碳酸钠;Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评:本题容易出错的地方是加入试剂的顺序的排法,关键要知道加入碳酸钠的作用,决定了碳酸钠必须放在氯化钡的后面.

练习册系列答案
相关题目
有一些物质,它们中的一些原子集团常作为一个整体参加反应,下列物质中不含有原子集团的是( )
| A、NH4NO3 |
| B、CuSO4 |
| C、CaCO3 |
| D、NaCl |
 铜、铁、铝是人类广泛使用的金属,它们与我们的生活息息相关.
铜、铁、铝是人类广泛使用的金属,它们与我们的生活息息相关.