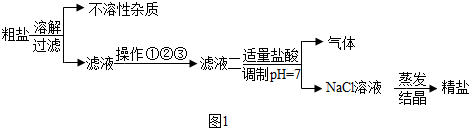
题目内容
将8g硫在给定质量的氧气里燃烧,有如下数据:
回答以下问题:
(1)以上数据说明,在三次实验中第 次恰好完全反应.
(2)第 次实验中硫有剩余,剩余 g.
(3)第 次实验中O2有剩余,剩余 g.
(4)三次实验化学反应过程中,是否有不符合质量守恒定律的? .
| 实验次数 | 给定氧的质量/g | 生成二氧化硫的质量/g |
| 第一次 | 7 | 14 |
| 第二次 | 8 | 16 |
| 第三次 | 10 | 16 |
(1)以上数据说明,在三次实验中第
(2)第
(3)第
(4)三次实验化学反应过程中,是否有不符合质量守恒定律的?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据质量守恒定律,若第一次实验8g硫与7g氧气反应,应生成二氧化硫质量=8g+7g=15g,而实际反应中只生成二氧化硫14g<15g说明两种物质未恰好完全反应,有一种物质有剩余;第二次实验8g硫与8g氧气与生成的16g二氧化硫,质量关系恰好符合质量守恒定律,说明此时反应为恰好完全反应;则第三次实验中氧气质量再增加至10g,因硫不足而氧气剩余.
解答:解:
(1)参加反应的各物质质量总和与反应生成物质量总和相等,符合这一要求的只有第二次实验,所以此次实验中两种物质恰好完全反应;
(2)由于第一次实验中氧气只有7g不足8g,所以硫会有剩余;剩余硫的质量=15g-14g=1g;
(3)根据第二次完全反应,说明硫和氧气按1:1的质量比进行反应,8g硫最多可消耗8g氧气,那么氧气剩余的质量为:6g+10gg-16g=2g;
(4)化学反应都遵循质量守恒定律.
答案:(1)二 (2)一 1 (3)三 2 (4)没有
(1)参加反应的各物质质量总和与反应生成物质量总和相等,符合这一要求的只有第二次实验,所以此次实验中两种物质恰好完全反应;
(2)由于第一次实验中氧气只有7g不足8g,所以硫会有剩余;剩余硫的质量=15g-14g=1g;
(3)根据第二次完全反应,说明硫和氧气按1:1的质量比进行反应,8g硫最多可消耗8g氧气,那么氧气剩余的质量为:6g+10gg-16g=2g;
(4)化学反应都遵循质量守恒定律.
答案:(1)二 (2)一 1 (3)三 2 (4)没有
点评:根据质量守恒定律,反应物质恰好完全反应,参加反应的反应物质质量总和一定等于生成物质量总和.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
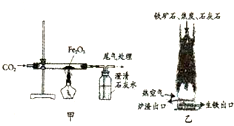 请用化学知识回答下列问题.
请用化学知识回答下列问题.