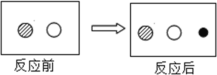题目内容
【题目】质量守恒定律的发现对化学的发展做出了重要贡献.
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是_______(填标号)
a.蔗糖和水 b.氯化钠溶液和硝酸钾溶液 c.铜和硝酸银溶液
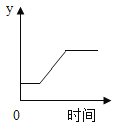
(2)在氧气中点燃红磷的实验过程,固体变化如图1所示。
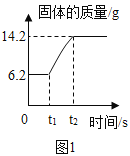
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是______________
②该反应的化学方程式为_____________________
③参加反应的氧气质量为_______g.
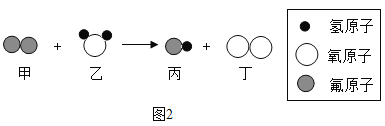
(3)某反应的微观示意图如图2所示,参加反应的甲物质和生成的丙物质分子数目比为_______
【答案】C 温度未达到红磷的着火点,反应未开始 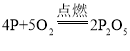 8 1:2
8 1:2
【解析】
(1)A、蔗糖和水是溶解过程,是物理变化,不能用于验证质量守恒定律;
B、氯化钠溶液和硝酸钾溶液,相互之间不反应,不能用于验证质量守恒定律;
C、铁和氯化铜溶液,铁比铜活泼,可以将铜置换出来,是化学变化,能用于验证质量守恒定律;
故选:C。
(2)①从燃烧条件分析,固体质量在t1前没有发生变化的原因为温度未达到红磷的着火点,反应未开始;
②红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为: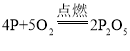 。
。
③从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,固体增加的质量为参加反应的氧气的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
(3)由物质的微观构成可知,该反应的化学方程式为:![]() ;参加反应的甲物质和生成的丙物质分子数目比为2:4=1:2。
;参加反应的甲物质和生成的丙物质分子数目比为2:4=1:2。

 阅读快车系列答案
阅读快车系列答案【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:
(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体。
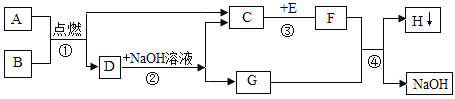
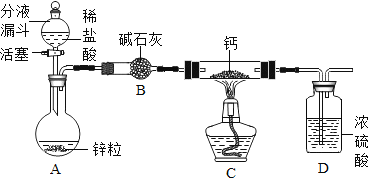
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_______;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后的实验步骤正确的顺序是____(填序号)。
A 加热反应一段时间
B 收集装置最右端导管口处的气体并检验其纯度
C 关闭分液漏斗活塞
D 停止加热,充分冷却
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入酚酞试液后显______色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_______。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将该气体的燃烧产物通入澄清石灰水中,无现象,则该气体为______(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因:_________。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
CaH2可用于冶金工业,还可以作为轻便的氢气发生剂,现有126克纯净的CaH2,加入足量水中,理论上可获得氢气____升?(常温常压下,氢气的密度为0.09g/L,结果保留一位小数)
【题目】为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关数据如下表:
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
150g | 12g | 157.6g |
(1)反应中生成二氧化碳的质量为多少?
(2)求该石灰石中碳酸钙的质量分数.