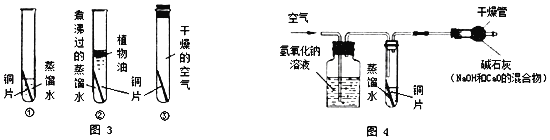
题目内容
【题目】1811年由意大利化学家阿伏加德罗提出假说:在同温同压下,气体的体积之比等于分子个数之比,后来被科学界所承认。载人航天器工作舱中的空气要与地球上的空气基本一致。
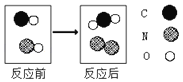
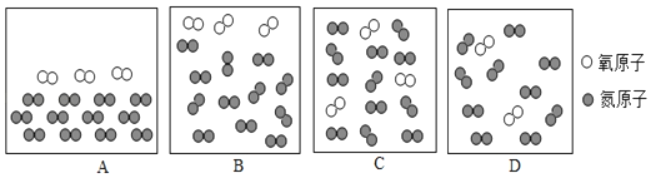
(1)用微观示意图表示工作舱中空气的主要成分,图中最合理的是_____(填序号)。
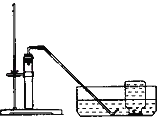
(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为_____。
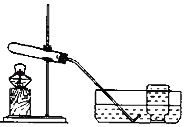
(3)实验室用KMnO4制取O2 的化学方程式为_____。
(4)分离液态空气法制取氧气发生的是_____变化。
【答案】C; CO2+2LiOH=Li2CO3+H2O. 2KMnO4![]() K2MnO4+MnO2+O2↑. 物理。
K2MnO4+MnO2+O2↑. 物理。
【解析】
(1)空气中氧气和氮气的体积比是1:4,由于在同温同压下,气体的体积之比等于分子个数之比,则氧气和氮气的分子之比是:1:4,分子是不断运动,分子应均匀的混合在一起,用微观示意图表示工作舱中空气的主要成分,图中最合理的是C;
(2)宇航员呼出的CO2用氢氧化锂(LiOH)吸收,生成Li2CO3和H2O,反应的化学方程式为:CO2+2LiOH=Li2CO3+H2O。
(3)实验室用KMnO4制取O2的化学方程式为:
2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(4)分离液态空气法制取氧气的过程中没有新物质生成,发生的是物理变化。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】小明参观某养鱼池时,发现农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,可做增氧剂、杀菌剂等。
(猜想与论证)
(1)小明依据_____,提出猜想Ⅰ。
(猜想Ⅰ)加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置气密性。操作如下:想将导管伸入液面下,用手紧握试管,观察到_____,松开后,有液体进入导管。 ②加入过氧化钙,加热,导管口有大量气泡冒出。 ③收集一瓶气体。 ④停止加热。熄灭酒精灯前,应_____。 ⑤检验气体。方法是_____。 |
(实验结论)加热过氧化钙可制取氧气。
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎看不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
(实验结论)不能用过氧化钙与水反应制取氧气,原因是_____。
(分析与反思)
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是_____。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?你的合理建议:_____。