题目内容
小强学习了金属活动顺序后,觉得非常神奇和有趣,刚好有一次机会到化学实验室做实验,他决定自己做一个探究实验。
(1)他猜想:假如将金属钠放入到硫酸铜溶液中,能不能把铜置换出来呢?
假如他的猜想正确,反应的化学方程式为: ,
实验的现象为(写两点) 。
(2)进行实验:他将保存在煤油中的金属钠用镊子取出,用滤纸吸干表面的煤油,然后用小刀将金属钠切下绿豆大小的一块放入到装有100mL5%硫酸铜溶液的250mL烧杯中,在烧杯口盖上一块玻璃片,观察到金属钠在溶液表面剧烈反应,四处游动,有“嘶嘶”声,熔化并燃烧,有轻微爆炸声,反应完毕后观察到溶液中有蓝色絮状沉淀和少量黑色固体。
(3)为什么会得到与猜想不同的实验现象呢?小强通过查阅资料知道:金属钠的化学性质非常活泼,能与水反应生成一种可燃性气体和另一种能使无色酚酞变红的物质,同时放出大量的热;氢氧化镁受热时能分解生成两种氧化物,其它难溶的氢氧化物也有类似的化学性质。
(4)分析与小结:小强通过资料并结合实验现象,认为该实验过程中可能发生了三个化学反应,请依次写出反应的化学方程式 , ,
。
(5)反思与交流:通过(2)可知金属钠有什么物理性质(写出一点即可)? 。
金属钠为什么要保存在煤油中(写出一点即可)? 。
(1)他猜想:假如将金属钠放入到硫酸铜溶液中,能不能把铜置换出来呢?
假如他的猜想正确,反应的化学方程式为: ,
实验的现象为(写两点) 。
(2)进行实验:他将保存在煤油中的金属钠用镊子取出,用滤纸吸干表面的煤油,然后用小刀将金属钠切下绿豆大小的一块放入到装有100mL5%硫酸铜溶液的250mL烧杯中,在烧杯口盖上一块玻璃片,观察到金属钠在溶液表面剧烈反应,四处游动,有“嘶嘶”声,熔化并燃烧,有轻微爆炸声,反应完毕后观察到溶液中有蓝色絮状沉淀和少量黑色固体。
(3)为什么会得到与猜想不同的实验现象呢?小强通过查阅资料知道:金属钠的化学性质非常活泼,能与水反应生成一种可燃性气体和另一种能使无色酚酞变红的物质,同时放出大量的热;氢氧化镁受热时能分解生成两种氧化物,其它难溶的氢氧化物也有类似的化学性质。
(4)分析与小结:小强通过资料并结合实验现象,认为该实验过程中可能发生了三个化学反应,请依次写出反应的化学方程式 , ,
。
(5)反思与交流:通过(2)可知金属钠有什么物理性质(写出一点即可)? 。
金属钠为什么要保存在煤油中(写出一点即可)? 。
2Na + CuSO4 ="==" Cu + Na2SO4 有红色固体生成,溶液蓝色变浅(变为无色)
2Na + 2H2O ="==" 2NaOH + H2↑ 2NaOH + CuSO4 ="==" Cu(OH)2↓ + Na2SO4
Cu(OH)2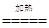 CuO + H2O 硬度小(熔点低等其他合理答案) 防止被空气中的氧气氧化(或其他合理答案)
CuO + H2O 硬度小(熔点低等其他合理答案) 防止被空气中的氧气氧化(或其他合理答案)
2Na + 2H2O ="==" 2NaOH + H2↑ 2NaOH + CuSO4 ="==" Cu(OH)2↓ + Na2SO4
Cu(OH)2
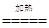 CuO + H2O 硬度小(熔点低等其他合理答案) 防止被空气中的氧气氧化(或其他合理答案)
CuO + H2O 硬度小(熔点低等其他合理答案) 防止被空气中的氧气氧化(或其他合理答案)试题分析:(1)假如他的猜想正确,反应的化学方程式为:2Na + CuSO4 ="==" Cu + Na2SO4,产生红色固体为铜单质,铜离子减少,蓝色变浅;(4)根据题意可知钠与水反应生成氢气和氢氧化钠,方程式为2Na + 2H2O ="==" 2NaOH + H2↑,生成的氢氧化钠和硫酸铜发生复分解反应,生成氢氧化铜和硫酸钠,方程式为2NaOH + CuSO4 ="==" Cu(OH)2↓ + Na2SO4,结合氢氧化镁氢氧化铜受热分解生成氧化铜和水;(5)由题可知钠的物理性质为硬度小、熔点低;(5)煤油可以隔绝空气,防止钠和空气中的成分反应。
点评:这是一道非常典型的探究题,题目给的知识点没有学过,较为陌生,但是重点考察的反应的思想,装置等,所以这种题目不要害怕,仔细审题即可。

练习册系列答案
相关题目
 验证猜想2
验证猜想2 验证猜想3
验证猜想3








