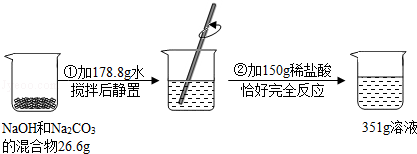
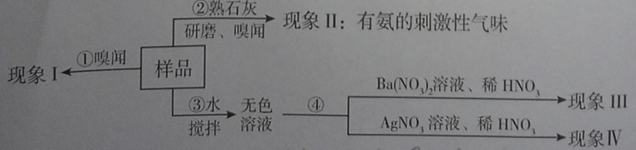
题目内容
李兴同学将BaCl2溶液与H2SO4溶液混合,得到一种浊液,该反应的化学方程式为 。李兴又将浊液过滤,并探究滤液的成分。
【提出猜想】
猜想1:滤液里的溶质只有HCl;
猜想2:滤液里的溶质有HCl和H2SO4;
猜想2:滤液里的溶质有HCl和 。
【设计验证实验】
操作I:滤液 验证猜想2
验证猜想2
操作II:滤液 验证猜想3
验证猜想3
其中操作 不能达到实验目的,应该将药品更换成 (填序号)。
【提出猜想】
猜想1:滤液里的溶质只有HCl;
猜想2:滤液里的溶质有HCl和H2SO4;
猜想2:滤液里的溶质有HCl和 。
【设计验证实验】
操作I:滤液
 验证猜想2
验证猜想2操作II:滤液
 验证猜想3
验证猜想3其中操作 不能达到实验目的,应该将药品更换成 (填序号)。
| A.AgNO3溶液 | B.BaCl2溶液 |
| C.NaHCO3固体 | D.金属铝 |
BaCl2+H2SO4=2HCl+BaSO4↓ BaCl2 Ⅰ B
由于发生BaCl2+H2SO4=2HCl+BaSO4↓,存在那种物质是否过量问题,若H2SO4过量,最后溶液中一定有H2SO4,若BaCl2过量,最后溶液中一定有BaCl2 ;操作I中向滤液中加锌,有气体产生,不能证明是和HCl或H2SO4产生的

练习册系列答案
相关题目