题目内容
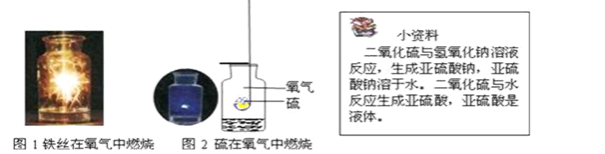
【题目】已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示:
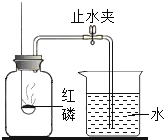
(1)红磷燃烧时的现象______![]() 该实验中红磷应过量,目的是______
该实验中红磷应过量,目的是______![]() 写出红磷燃烧的文字或符号表达式______
写出红磷燃烧的文字或符号表达式______![]() 此反应属于_______________。
此反应属于_______________。![]() 填反应类型
填反应类型![]()
(2)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水量约是集气瓶体积的______,由本实验还可以推知氮气的哪些性质?试写出其中的一种:______.
【答案】产生大量的白烟耗尽氧气红磷+氧气![]() 五氧化二磷化合反应五分之一不能燃烧;不支持燃烧;不溶于水
五氧化二磷化合反应五分之一不能燃烧;不支持燃烧;不溶于水![]() 答任一点即可
答任一点即可![]() ;
;
【解析】
(1)红磷燃烧时的现象产生大量的白烟;红磷应过量,目的是耗尽氧气;红磷燃烧生成五氧化二磷,文字表达式为红磷![]() 氧气
氧气![]() 五氧化二磷,该反应符合“多变一”的特征,属于化合反应;
五氧化二磷,该反应符合“多变一”的特征,属于化合反应;
(2)氧气占空气体积的五分之一,故打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水量约是集气瓶体积的五分之一;由本实验还可以推知氮气具有不能燃烧;不支持燃烧;不溶于水的性质。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据,判断下列说法错误的是
A. KNO3和NaCl的溶解度曲线在20℃—30℃温度范围内会相交
B. 在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%
C. 在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液
D. 从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法