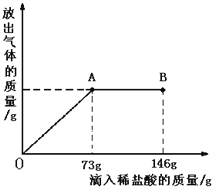
题目内容
【题目】根据如图信息,下列说法正确的是 ( )
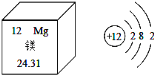
A. 镁属于非金属元素
B. 镁原子的相对原子质量为24.31g
C. 镁原子的核电荷数为12
D. 在化学反应中,镁原子容易得到电子形成Mg2+
【答案】C
【解析】在元素周期表中,元素名称的左上角数字为原子序数,右上角的为元素符号,下边的是相对原子质量。在原子结构示意图中,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。原子的化学性质主要由最外层电子数决定,当最外层电子数小于4时,反应中易失去电子成为阳离子;当最外层电子数大于4时,反应中易得到电子成为阴离子;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构,不易得失电子。离子是由原子的是电子形成的,失去电子时带正电荷,正电荷数等于失电子数,得电子时带负电荷,负电荷数等于得电子数。一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写;镁离子可表示为: Mg2+;选C

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】利用图1装置进行I、II两组实验,将滴管a中的液体滴入b中,待充分作用后,打开止水夹d。a、b、c中所加试剂如下表所示。
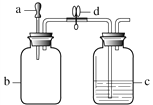
图1
实验 | a中试剂 | b中试剂 | c中试剂 |
I | 5%H2O2溶液 | MnO2 | 80 ℃热水 |
II | 石蕊溶液 | HCl气体 | NaOH溶液 |
已知:HCl气体极易溶解于水。白磷的着火点为40 ℃。
(1)实验I中,若在c中长导管口处放置一块白磷,当打开止水夹后,可观察到白磷燃烧,通过此实验能证明燃烧的条件是________。 若要证明燃烧的另一条件,在对比实验中,需将c中盛放的试剂改为________。
(2)实验II能证明NaOH与HCl发生了反应。实验过程中,打开止水夹d后,可观察到的现象为________。
(3)若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是________。

图2