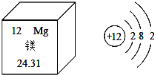
题目内容
【题目】Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
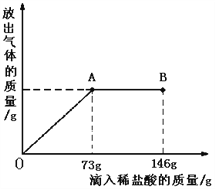
(1)当滴加稀盐酸至图中B点时,烧杯中溶的pH 7(填>、=、<)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
【答案】① < ②24.2%
【解析】试题分析:①根据图示,当滴加稀盐酸至图中A点时,表示所加的稀盐酸与Na2CO3恰好反应,而当滴加稀盐酸至图中B点时,表示盐酸过量,故此时烧杯中溶液的pH<7
②当滴加稀盐酸至图中A点时,表示所加的稀盐酸与Na2CO3恰好反应,根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中HCl与Na2CO3、NaCl的质量关系,可分别求出Na2CO3、NaCl的质量,进一步计算溶质的质量分数
解:设生成NaCl的质量为x,Na2CO3的质量为y,二氧化碳质量为z
Na2CO3 + 2HCl ="=" 2NaCl+H2O+CO2↑
106 73 117 44
y 73g×10% x z
73:117=73g×10%:x x=11.7g
73:106=73g×10%:y y=10.6g
73:44=73g×10%:z z=4.4g
故溶液中的溶质质量=(20.4-10.6g)+11.7g=21.5g
溶液的质量=20.4g+73g—4.4g=89g
所以溶质的质量分数=21.5g/89g×100%=24.2%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组以“稀硫酸与氢氧化钠溶液能否发生反应”为课题进行了科学探究。如图1所示,小组同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会儿会发现忘记了滴加指示剂,因此,他们停止滴加稀硫酸,并对烧杯内稀硫酸与氢氧化钠溶液是否发生了反应进行探究。

(1)小组同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH | pH 7 | 稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了 |
(2)写出该反应的化学方程式: 。
(3)同学们经过讨论一致认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组继续试验:
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。
【实验操作及现象】如图2,向a试管中滴加足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现蓝色沉淀。
【实验结论】通过以上实验操作及现象,你认为用CuSO4溶液 (填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应。
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。
【实验操作及现象】如图3,向b试管中滴加足量NaOH溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀。
【实验结论】通过以上实验操作及现象,你认为用BaCl2溶液 (填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应,理由是 。