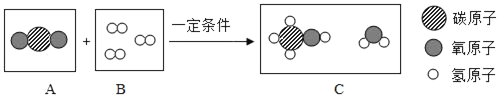
��Ŀ����
����Ŀ����ͼ�dz��л�ѧ�г������ʼ��ת����ϵ�����У���ͨ������£�F��G�����Ԫ����ͬ���������壬��E�������г��õĵ�ζ�����������������ַ�Ӧ������ȥ�����Իش��������⣺
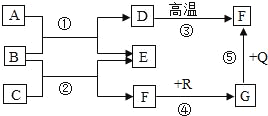
��1��д�����ʵĻ�ѧʽΪ��C_____��D_____��G_____��
��2����Ӧ���Ļ�ѧ����ʽΪ��_____��
��3��ͼ�б���ľ������ʰ����ʡ�������ᡢ��ν��з��࣬һ��û�е����������_____��
��4����Ӧ��������û���漰�Ļ�����Ӧ������_____��
���𰸡�HCl CaCO3 CO CaCl2+Na2CO3��CaCO3��+2NaCl ���� �û���Ӧ
��������
����ͼ�����Ŀ�е���Ϣ����E�������г��õĵ�ζ����������������E����NaCl����ͼD![]() F��D������CaCO3���Ȼ�����̼���Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ�A��CaCl2��BΪNa2CO3��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��CΪHCl�� F�����壬��FΪCO2��F��G�����Ԫ����ͬ���������壬һ����̼�������̼�����Ԫ����ͬ���������壬G��һ����̼��������̼��̼�ڸ���������һ����̼��R��̼��G��Q��Ӧ����F��������̼����һ����̼���������ڸ����������������Ͷ�����̼��Q�����������������������ͼ����м��飬�������⡣
F��D������CaCO3���Ȼ�����̼���Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ�A��CaCl2��BΪNa2CO3��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��CΪHCl�� F�����壬��FΪCO2��F��G�����Ԫ����ͬ���������壬һ����̼�������̼�����Ԫ����ͬ���������壬G��һ����̼��������̼��̼�ڸ���������һ����̼��R��̼��G��Q��Ӧ����F��������̼����һ����̼���������ڸ����������������Ͷ�����̼��Q�����������������������ͼ����м��飬�������⡣
�������Ϸ�����֪��
��1��CΪHCl��D��CaCO3��G��CO��
��2����Ӧ�����Ȼ�����̼���Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ���ѧ����ʽΪCaCl2+Na2CO3��CaCO3��+2NaCl��
��3��A��CaCl2�����Σ�B��Na2CO3�����Σ�C��HCl�����ᣬD��CaCO3�����Σ�E��NaCl�����Σ�F��CO2���������G��CO���������R��̼���ڵ��ʣ�Q���������������������Щ������û�м������ʣ�
��4����Ӧ�٢ڶ�Ϊ���ֽⷴӦ����Ϊ̼��ƵķֽⷴӦ����Ϊ������̼��̼�����Ļ��Ϸ�Ӧ����Ϊһ����̼������ͭ�ķ�Ӧ����Ӧ�١�����û���漰�Ļ�����Ӧ���������з�Ӧ��û���û���Ӧ��

����Ŀ��ij���������ij����̼���Ʋ�Ʒ�п��ܺ����Ȼ������ʡ�
���Լ���
(1)Ҫȷ���ò�Ʒ���Ƿ��������Ȼ��ƣ���ķ�����_________________��
�����ⶨ:
(2)�����ó������ⶨ�ò�Ʒ��̼���Ƶ�������������ȷ���ķ�Ӧԭ����(�û�ѧ����ʽ��ʾ)_______________________________��
(3)������ȡ��������Ϊm1��������ȷ���ķ�Ӧԭ��������Ҫͨ��ʵ���������(�ѧʽ)____������(�������õij���������Ϊm2)��
(4)�������ʵ�鷽�����������m1��m2���ѷ��������±��С�
���õ��������� | ʵ�鲽�� |
____________ | ______ |
(5)���ݴ�����
���ú�m1��m2��ʽ�ӱ�ʾ������Ʒ��̼���Ƶ�����������______________________��
��������:
(6)Ҫ�ⶨ�������ij�ɷֵĺ�������ͨ����ѧ���������ײⶨ������ת��Ϊ�ײ��������ʡ����������⣬�������ݷ�Ӧ(�û�ѧ����ʽ��ʾ)_______________���ⶨ�ô�����Ʒ��̼���Ƶ�����������
����Ŀ�����и������ʼ���ͨ��һ����Ӧ����ʵ����ͼת�����ǣ�������
X | Y | Z | |
A | Fe | FeCl2 | Fe2O3 |
B | O2 | CuO | Cu |
C | AgNO3 | Ba��NO3��2 | BaSO4 |
D | Ca��OH��2 | NaOH | H2O |

A. AB. BC. CD. D