题目内容
【题目】(1)探究金属性质:
图1是探究金属化学性质,图2是金属化学性质网络图。
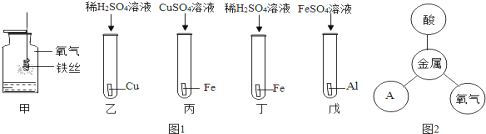
①图1甲中反应现象是________________,其反应的化学方程式为_________________;
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,
由强到弱的顺序是_____________(填元素符号);依据图1完成金属性质网络,图2中的A属于________(填物质类别);
【答案】 剧烈燃烧,火星四射,生成黑固体 3Fe+O2 ![]() Fe3O4 Al>Fe>H>Cu 盐
Fe3O4 Al>Fe>H>Cu 盐
【解析】(1). 铁丝能在氧气中剧烈燃烧,火星四射,生成黑固体;反应方程式为3Fe+O2 点燃Fe3O4 (2). 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。图1只有乙中不反应,说明只有铜在氢的后边;铁与硫酸铜溶液反应,说明铁在铜之前;铝能与硫酸亚铁溶液反应说明,铝的活动性比铁的强,所以三种金属以及和氢元素的顺序是:Al>Fe>H>Cu (4). 初中阶段学习的金属的化学性质表现为三方面:和氧气反应;某些金属和酸反应;某些金属和盐溶液反应。所以A为盐。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案【题目】下图的锥形瓶内是空气,试管中盛有部分水,现向试管中加入某种物质后,会使U形管内b处的液面高于a处的液面。则该物质不可能是………( )
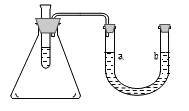
A. 氯化钠 B. 浓硫酸 C. 生石灰 D. 氢氧化钠固体
【题目】测定空气中氧气含量的实验:
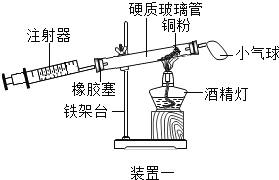

(1)实验中,气球的作用是___________;反应的原理为_____________(用化学方程式表示);该反应的基本反应类型是_______;装置一比装置二更合理,理由是:_________
(2)根据下表提供的实验数据,完成下表:
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
30mL | 20mL | 12mL | ________________ |
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
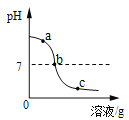
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。