题目内容
某同学在家里测定了一些液体的pH,他的测定或记录一定有错误的是( )
【答案】分析:利用常见物质溶液的酸碱性,对所测定或记录的pH进行判断;当溶液的PH等于7时,呈中性.当溶液的PH大于7时,呈碱性.当溶液的PH小于7时,呈酸性.
解答:解:A、人体的血液呈中性,PH可能是7.4.记录正确;
B、肥皂水呈碱性,PH可能是10.记录正确;
C、食盐水呈中性,PH应该是7,不可能是8.记录错误;
D、人的唾液显中性,PH=7.记录正确.
故选C.
点评:解答本题要理解一些常见物质的酸碱性,然后再根据溶液的酸碱性与PH之间的关系进行分析、判断,从而得出正确的结论.
解答:解:A、人体的血液呈中性,PH可能是7.4.记录正确;
B、肥皂水呈碱性,PH可能是10.记录正确;
C、食盐水呈中性,PH应该是7,不可能是8.记录错误;
D、人的唾液显中性,PH=7.记录正确.
故选C.
点评:解答本题要理解一些常见物质的酸碱性,然后再根据溶液的酸碱性与PH之间的关系进行分析、判断,从而得出正确的结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
金属材料在生活、生产、科技等方面普遍使用.
(1)我市某企业因经营不善而停工,一年多来,许多机械设备上已锈迹斑斑.乐乐同学将设备上一枚生锈的铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为______;一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式______;乐乐结合学过的化学知识,向留守的管理人员提出了一些防止机械设备进一步锈蚀的建议,请写出一条乐乐的建议:______.
(2)钛(Ti)是航天航空、化工等方面的重要金属材料,被称为“21世纪的金属”.工业上用镁在高温下与TiCl4反应制取,化学方程式为:TiCl4+2Mg Ti+2MgCl2.该反应说明金属钛的活动性比镁______(填“强”或“弱”).
Ti+2MgCl2.该反应说明金属钛的活动性比镁______(填“强”或“弱”).
(3)黄铜为铜锌合金,用途极为广泛.小华同学从家里带来了黄铜碎片,准备与同学们一起来测量其中的铜含量.他们决定先测定黄铜与酸反应产生的氢气的量,再计算.
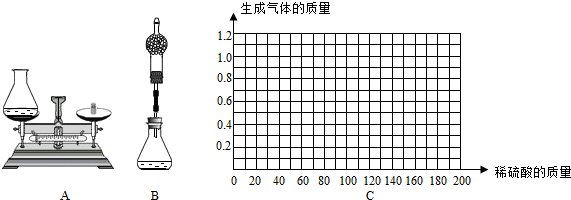
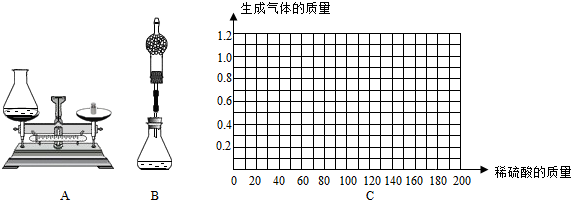
①小华用设计出的上图A方案测定:
Ⅰ.称量黄铜样品、锥形瓶及稀硫酸的质量.
Ⅱ.黄铜样品放入锥形瓶并倒入稀硫酸.
Ⅲ.待反应完毕后再测锥形瓶和反应后混合物的总质量,反应前后总质量差为产生氢气的质量.
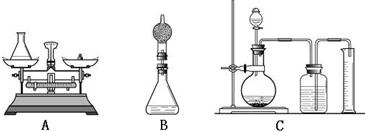
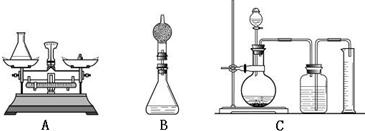
②小海对小华的设计提出改进建议:在上述方案中的锥形瓶上加一装有干燥剂的干燥管,测定反应前后装置的质量差.请你说明小海进行改进的理由是:______.
③欢欢同学为了测定黄铜样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
Ⅰ.经分析,在第1份样品测得的数据中,______(填物质名称)完全反应了.
Ⅱ.请在图C中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
Ⅲ.试计算黄铜屑样品中的锌的质量分数.(写出计算过程.计算结果保留一位小数).
 Ti+2MgCl2。该反应说明金属钛的活动性比镁 (填“强”或“弱”)。
Ti+2MgCl2。该反应说明金属钛的活动性比镁 (填“强”或“弱”)。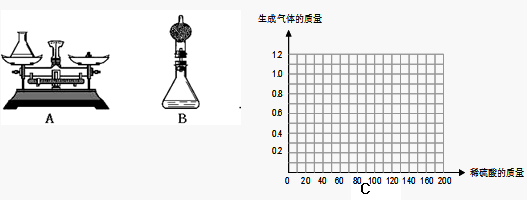
 质量差。请你说明小海进行改进的理由是: 。
质量差。请你说明小海进行改进的理由是: 。