题目内容
金属材料在生活、生产、科技等方面普遍使用.
(1)我市某企业因经营不善而停工,一年多来,许多机械设备上已锈迹斑斑.乐乐同学将设备上一枚生锈的铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为
(2)钛(Ti)是航天航空、化工等方面的重要金属材料,被称为“21世纪的金属”.工业上用镁在高温下与TiCl4反应制取,化学方程式为:TiCl4+2Mg
Ti+2MgCl2.该反应说明金属钛的活动性比镁
(3)黄铜为铜锌合金,用途极为广泛.小华同学从家里带来了黄铜碎片,准备与同学们一起来测量其中的铜含量.他们决定先测定黄铜与酸反应产生的氢气的量,再计算.
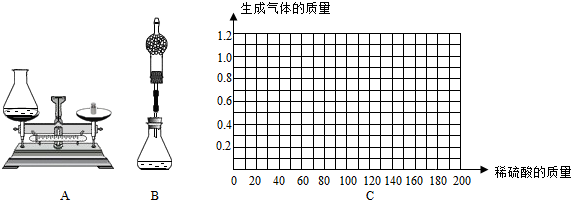
①小华用设计出的上图A方案测定:
Ⅰ.称量黄铜样品、锥形瓶及稀硫酸的质量.
Ⅱ.黄铜样品放入锥形瓶并倒入稀硫酸.
Ⅲ.待反应完毕后再测锥形瓶和反应后混合物的总质量,反应前后总质量差为产生氢气的质量.
②小海对小华的设计提出改进建议:在上述方案中的锥形瓶上加一装有干燥剂的干燥管,测定反应前后装置的质量差.请你说明小海进行改进的理由是:
③欢欢同学为了测定黄铜样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
Ⅰ.经分析,在第1份样品测得的数据中,
Ⅱ.请在图C中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
Ⅲ.试计算黄铜屑样品中的锌的质量分数.(写出计算过程.计算结果保留一位小数).
(1)我市某企业因经营不善而停工,一年多来,许多机械设备上已锈迹斑斑.乐乐同学将设备上一枚生锈的铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为
Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
;一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
;乐乐结合学过的化学知识,向留守的管理人员提出了一些防止机械设备进一步锈蚀的建议,请写出一条乐乐的建议:保持铁制品表面干燥(其他合理答案均可)
保持铁制品表面干燥(其他合理答案均可)
.(2)钛(Ti)是航天航空、化工等方面的重要金属材料,被称为“21世纪的金属”.工业上用镁在高温下与TiCl4反应制取,化学方程式为:TiCl4+2Mg
| ||
弱
弱
(填“强”或“弱”).(3)黄铜为铜锌合金,用途极为广泛.小华同学从家里带来了黄铜碎片,准备与同学们一起来测量其中的铜含量.他们决定先测定黄铜与酸反应产生的氢气的量,再计算.

①小华用设计出的上图A方案测定:
Ⅰ.称量黄铜样品、锥形瓶及稀硫酸的质量.
Ⅱ.黄铜样品放入锥形瓶并倒入稀硫酸.
Ⅲ.待反应完毕后再测锥形瓶和反应后混合物的总质量,反应前后总质量差为产生氢气的质量.
②小海对小华的设计提出改进建议:在上述方案中的锥形瓶上加一装有干燥剂的干燥管,测定反应前后装置的质量差.请你说明小海进行改进的理由是:
反应过程中有水蒸气随着氢气逸出
反应过程中有水蒸气随着氢气逸出
.③欢欢同学为了测定黄铜样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
Ⅰ.经分析,在第1份样品测得的数据中,
硫酸
硫酸
(填物质名称)完全反应了.Ⅱ.请在图C中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
Ⅲ.试计算黄铜屑样品中的锌的质量分数.(写出计算过程.计算结果保留一位小数).
分析:(1)螺丝钉表面是铁锈主要成分是三氧化二铁,放入盐酸后后首先是铁锈反应,铁锈完全反应后铁再和盐酸反应产生气泡,根据铁的生锈条件判读防锈的方式.
(2)根据镁、钛的置换关系,判断两种金属的活动性强弱;
(3)②依据生成氢气的同时容易带走少量的水蒸气分析加干燥管的原因;
I.第一份和第二份比较可以发现,当硫酸的质量增加时,气体的质量也在增加,说明第一份中金属没有完全反应,也说明硫酸完全反应.
II.找出起点,最大值,曲线的走势绘制图象即可.
III.比较第三份和第四份可以发现,当硫酸的质量增加时,气体的质量保持不变,说明合金完全反应放出气体的质量是1克.然后写出化学方程式并计算锌的质量和H2SO4的质量.
(2)根据镁、钛的置换关系,判断两种金属的活动性强弱;
(3)②依据生成氢气的同时容易带走少量的水蒸气分析加干燥管的原因;
I.第一份和第二份比较可以发现,当硫酸的质量增加时,气体的质量也在增加,说明第一份中金属没有完全反应,也说明硫酸完全反应.
II.找出起点,最大值,曲线的走势绘制图象即可.
III.比较第三份和第四份可以发现,当硫酸的质量增加时,气体的质量保持不变,说明合金完全反应放出气体的质量是1克.然后写出化学方程式并计算锌的质量和H2SO4的质量.
解答:解:(1)因为Fe2O3会与盐酸反应,所以当把一枚生锈的铁螺丝放入足量的稀盐酸中时,观察到铁锈逐渐消失,当表面的铁锈消耗完后,露出来的铁又继续与盐酸反应生成氢气,所以观察到铁钉表面有气泡产生.方程式为:Fe2O3+6HCl═2FeCl3+3H2O、Fe+2HCl═FeCl2+H2↑,防止铁生锈有多种方法,如:保持铁制品干燥;铁制品表面刷油漆等.
(2)金属活动顺序表中前边的金属会把后边的金属置换出来,因为镁能把钛置换出来,所以钛没有镁活泼.
(3)②因为当氢气逸出来的同时,水蒸气也会随氢气逸出来,所以前后两次质量差也包含氢气所带出的水蒸气的质量.
③I第一份和第二份比较可以发现,当硫酸的质量增加时,气体的质量也在增加,说明第一份中金属没有完全反应,也说明硫酸完全反应.
II起点:当没有硫酸加入时,就没有气体的放出,因此起点是(0,0);比较第一份和第二份可以发现,每加入40克硫酸,气体就会多放出0.4克,因此要想放出1.0克气体,需要加入硫酸的质量是100克,因此最高点是(100,1.0);比较第一份和第二份可以发现,硫酸的质量和气体的质量的比值相等(斜率相同),所以图象是一条直线.
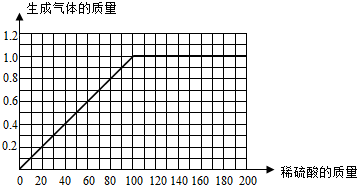
III比较第三份和第四份可以发现,当硫酸的质量增加时,气体的质量保持不变,说明合金完全反应放出气体的质量是1克,设参加反应的锌的质量为x.
设参加反应的锌的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1.0 g
=
x=32.5g
∴黄铜屑样品中的锌的质量分数为
×100%=65.0%
答:黄铜屑样品中的锌的质量分数为65%.
故答案为:
(1)Fe2O3+6HCl═2FeCl3+3H2O; Fe+2HCl═FeCl2+H2↑; 保持铁制品表面干燥(其他合理答案均可)
(2)弱;
(3)②反应过程中有水蒸气随着氢气逸出;
③Ⅰ.硫酸;
Ⅱ.

III.答:黄铜屑样品中的锌的质量分数为65%.
(2)金属活动顺序表中前边的金属会把后边的金属置换出来,因为镁能把钛置换出来,所以钛没有镁活泼.
(3)②因为当氢气逸出来的同时,水蒸气也会随氢气逸出来,所以前后两次质量差也包含氢气所带出的水蒸气的质量.
③I第一份和第二份比较可以发现,当硫酸的质量增加时,气体的质量也在增加,说明第一份中金属没有完全反应,也说明硫酸完全反应.
II起点:当没有硫酸加入时,就没有气体的放出,因此起点是(0,0);比较第一份和第二份可以发现,每加入40克硫酸,气体就会多放出0.4克,因此要想放出1.0克气体,需要加入硫酸的质量是100克,因此最高点是(100,1.0);比较第一份和第二份可以发现,硫酸的质量和气体的质量的比值相等(斜率相同),所以图象是一条直线.

III比较第三份和第四份可以发现,当硫酸的质量增加时,气体的质量保持不变,说明合金完全反应放出气体的质量是1克,设参加反应的锌的质量为x.
设参加反应的锌的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1.0 g
| 65 |
| x |
| 2 |
| 1.0g |
x=32.5g
∴黄铜屑样品中的锌的质量分数为
| 32.5g |
| 50g |
答:黄铜屑样品中的锌的质量分数为65%.
故答案为:
(1)Fe2O3+6HCl═2FeCl3+3H2O; Fe+2HCl═FeCl2+H2↑; 保持铁制品表面干燥(其他合理答案均可)
(2)弱;
(3)②反应过程中有水蒸气随着氢气逸出;
③Ⅰ.硫酸;
Ⅱ.

III.答:黄铜屑样品中的锌的质量分数为65%.
点评:此题是有关金属知识的考查题,题目中涉及的知识点以及应用较多,能够较好的对相关知识进行训练和考查;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.
 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛. 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.