题目内容
金属材料在生活、生产、科技等方面普遍使用.
(1)我县某企业因经营不善而停工,一年多来,许多机械设备上已锈迹斑斑.晴晴同学将设备上一枚生锈的铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为______;一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式______;晴晴结合学过的化学知识,向留守的管理人员提出了一些防止机械设备进一步锈蚀的建议,请写出一条晴晴的建议:______.
(2)钛(Ti)是航天航空、化工等方面的重要金属材料,被称为“21世纪的金属”.工业上用镁在高温下与TiCl4反应制取,化学方程式为:TiCl4+2Mg Ti+2MgCl2.反应说明金属钛的活动性比镁______(填“强”或“弱”).
Ti+2MgCl2.反应说明金属钛的活动性比镁______(填“强”或“弱”).
(3)黄铜为铜锌合金,用途极为广泛,可用于制造供排水管、奖章、波纹管、蛇形管、冷凝管、弹壳及各种形状复杂的冲压制品、小五金件等.小华同学从家里带来了黄铜碎片,准备与同学们一起来测量其中的铜含量.他们决定先测定黄铜与酸反应产生的氢气的量,再计算.
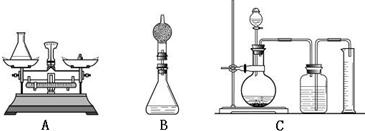
①小华用设计出的上图A方案测定:先称量黄铜样品、锥形瓶及稀硫酸的质量,黄铜样品放入锥形瓶并倒入稀硫酸,待反应完毕后再测锥形瓶和反应后混合物的总质量,反应前后总质量差为产生氢气的质量.写出该反应的化学方程式:______.
②小海对小华的设计提出质疑后,在上述方案中的锥形瓶上加一装有干燥剂的干燥管,测定反应前后装置的质量差.请你说明小海质疑的理由是:______.
③晴晴通过思考后,觉得他们的方案由于产生氢气质量小,在天平上称量误差都较大,于是晴晴设计(如上图C)的方案.取了1.0g黄铜,加入足量的稀硫酸后,在量筒中收集到了111mL的水.已知该条件下氢气的密度为0.09g/L,请计算该黄铜中铜的质量分数(计算结果保留一位小数).
解:(1)因为Fe2O3会与盐酸反应,所以当把一枚生锈的铁螺丝放入足量的稀盐酸中时,观察到铁锈逐渐消失,当表面的铁锈消耗完后,露出来的铁又继续与盐酸反应生成氢气,所以观察到铁钉表面有气泡产生.防止铁生锈有多种方法,如:保持铁制品干燥;铁制品表面刷油漆等.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O、Fe+2HCl═FeCl2+H2↑ 保持铁制品表面干燥(其他合理答案均可)
(2)金属活动顺序表中前边的金属会把后边的金属置换出来,因为镁能把钛置换出来,所以钛没有镁活泼.
故答案为:弱
(3)①镁会与稀硫酸反应,故答案为:Zn+H2SO4═ZnSO4+H2↑②因为当清漆逸出来的同时,水蒸气也会随氢气逸出来,所以前后两次质量差也包含氢气所带出的水蒸气的质量.
故答案为:反应过程中有水蒸气随着氢气逸出
③解:设黄铜中锌的质量为x,则
m(H2)=0.09g/L×0.111L=9.99×10-3g
Zn+H2SO4═ZnSO4+H2↑
65 2
x 9.99×10-3
解得x=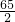 ×9.99×10-3=0.325g
×9.99×10-3=0.325g
所以Cu的质量=1.0g-0.325g=0.675g
所以该黄铜中铜的质量分数为67.5%
答:黄铜中铜的质量分数为67.5%.
分析:(1)根据Fe2O3、Fe能与盐酸反应去分析;
(2)根据金属活动顺序表中前边的金属能把后边的金属置换出来;
(3)①Zn能与稀硫酸反应;②根据实验过程分析;③根据排出水的体积等于生成气体的体积去计算.
点评:当气体不溶于水时,可以利用排出水的体积等于生成气体的体积去计算.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O、Fe+2HCl═FeCl2+H2↑ 保持铁制品表面干燥(其他合理答案均可)
(2)金属活动顺序表中前边的金属会把后边的金属置换出来,因为镁能把钛置换出来,所以钛没有镁活泼.
故答案为:弱
(3)①镁会与稀硫酸反应,故答案为:Zn+H2SO4═ZnSO4+H2↑②因为当清漆逸出来的同时,水蒸气也会随氢气逸出来,所以前后两次质量差也包含氢气所带出的水蒸气的质量.
故答案为:反应过程中有水蒸气随着氢气逸出
③解:设黄铜中锌的质量为x,则
m(H2)=0.09g/L×0.111L=9.99×10-3g
Zn+H2SO4═ZnSO4+H2↑
65 2
x 9.99×10-3
解得x=
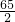 ×9.99×10-3=0.325g
×9.99×10-3=0.325g所以Cu的质量=1.0g-0.325g=0.675g
所以该黄铜中铜的质量分数为67.5%
答:黄铜中铜的质量分数为67.5%.
分析:(1)根据Fe2O3、Fe能与盐酸反应去分析;
(2)根据金属活动顺序表中前边的金属能把后边的金属置换出来;
(3)①Zn能与稀硫酸反应;②根据实验过程分析;③根据排出水的体积等于生成气体的体积去计算.
点评:当气体不溶于水时,可以利用排出水的体积等于生成气体的体积去计算.

练习册系列答案
相关题目

 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.
 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛. 金属材料在生活、生产中应用十分广泛.
金属材料在生活、生产中应用十分广泛.