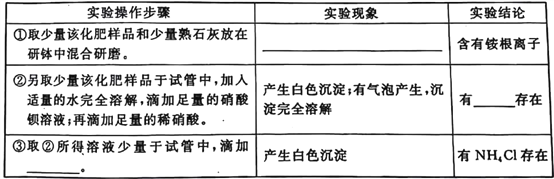
题目内容
【题目】法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下几个反应阶段:①原料氯化钠与浓硫酸在高温下反应得到产物硫酸钠和氯化氢气体,②在1000℃条件下通过硫酸钠与木炭反应生成硫化钠和二氧化碳,③生成的硫化钠继续和碳酸钙反应来得到碳酸钠。请完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是_________kg。
(2)反应②中碳单质过量时也同样可以反应获得Na2S,此时所发生的反应化学方程式是_______。
【答案】 0.883 Na2SO4+4C=======Na2S+4CO↑
【解析】(1)每步的反应物的反应的量足够,故根据原子守恒,氯化钠与碳酸钠的数量关系式为
2NaCl------- Na2CO3,设1kg纯度为80%的纯碱需要氯化钠的质量为x
2NaCl------- Na2CO3
117 106
x 1Kg![]()
![]() =
=![]() 解得x=0.883 Kg
解得x=0.883 Kg
(2)反应②中碳单质过量时硫酸钠与碳反应生成硫化钠和一氧化碳,反应方程式为Na2SO4+4C==Na2S+4CO↑

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目