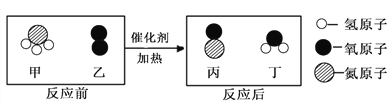
题目内容
【题目】实验室中有一桶含Fe2(SO4)3、FeSO4、CuSO4和H2SO4的废液。他们想从中回收铜并制取“还原铁粉” ,主要步骤如图所示。
查阅资料:Fe2(SO4)3 + Fe=3FeSO4 ,FeCO3 ![]() FeO+CO2↑
FeO+CO2↑
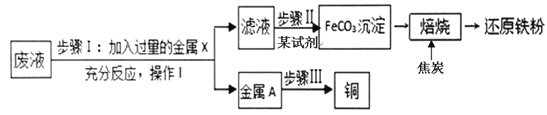
(1)金属X为_______,步骤I加入过量的金属X后发生了________个化学反应。
(2)金属A中的成分有______,步骤III可采用最简单的方法为 _____________________ 。
(3)在此流程中一定需要用到过滤操作的步骤是 ___________(填Ⅰ~Ⅲ)。
(4)FeCO3沉淀隔绝空气进行“焙烧”后,加入焦炭才能制得铁粉,写出加入焦炭后发生反应的化学方程式________________________________ 。
【答案】 铁 3 铁 铜 磁铁吸引 I 、 II C+2FeO![]() 2Fe+CO2
2Fe+CO2
【解析】本题主要考查了金属活动性顺序表的应用。熟记金属活动性顺表并理解其应用,除杂的原则及化学方程式的书写是解答本题的关键。
(1)由流程图和题意可知,步骤I加入过量的金属X是铁,铁可以与硫酸发生置换反应生成硫酸亚铁和氢气、还可以与硫酸铜发生置换反应生成硫酸亚铁和铜;铁还可以与硫酸铁发生化合反应生成硫酸亚铁;共发生3个反应;
(2)由流程图可知,金属A中的成分有过量的铁和生成的铜两种;铁以能被磁铁吸引,铜不能被磁铁吸引,步骤III可采用最简单的方法为磁铁吸引;
(3)由流程图可知,步骤是Ⅰ、Ⅱ是将固体与液体分离。在此流程中需要用到过滤操作的是步骤是Ⅰ、Ⅱ;
(4)FeCO3沉淀隔绝空气进行“焙烧”后生成了氧化亚铁和二氧化碳,氧化亚铁与焦炭高温(或焙烧)下反应生成铁和二氧化碳,化学方程式是:C+2FeO![]() 2Fe+CO2。
2Fe+CO2。

 阅读快车系列答案
阅读快车系列答案【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)