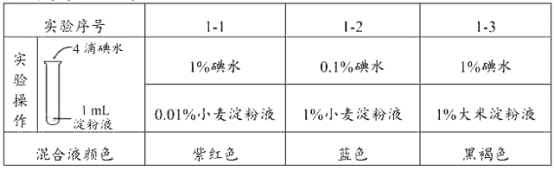
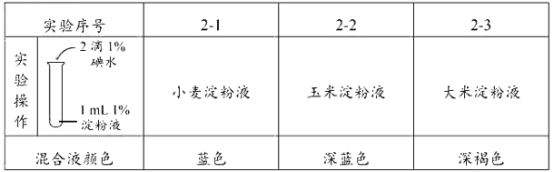
题目内容
【题目】水、空气都是维持生命的必须物质。请结合生产生活完成下列问题。天然水需净化才能饮用,如图是水厂净化水的过程:
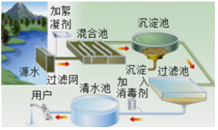
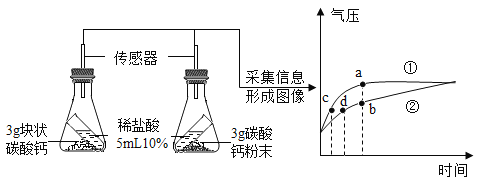
(1)下列属于该自来水厂净水方法的是______(填字母序号)。
A.沉淀 B.过滤 C.消毒 D.蒸馏
(2)“氧气“要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过(反应条件省略),见图.“箭头”画出了氧气应行走的路线,“氧气同学“不能从甲处通过,你认为甲处放的物质是______(填字母)。
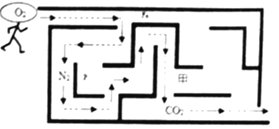
A.木炭 B.水 C.铁 D.浓硫酸
(3)如图是自然界中碳循环的示意图:
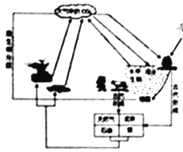
①根据图,举出产生二氧化碳的一种途径______。
②海水吸收也是自然界中二氧化碳消耗的一种重要途径,二氧化碳和水反应的化学方程式为______。
(4)大气中二氧化碳含量不断升高,使全球气候问题日趋严重。科学家们正在努力尝试通过下列途径减少二氧化碳的排放:利用氢氧化钠溶液来“捕捉”二氧化碳,并将二氧化碳储存或利用,流程如图所示。
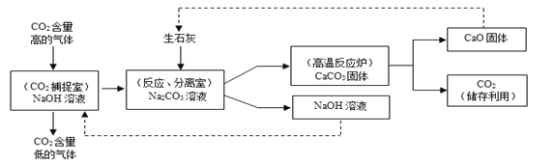
①反应,分离室中发生的复分解反应的化学反应方程式为______。
②下列有关该过程的叙述错误的是______。
A.该过程可实现CO2零排放
B.该过程至少发生了4个化学反应
C.该过程只有1种物质可以循环利用
D.“反应、分离”的过程中,分离物质的操作是蒸发、结晶
【答案】ABC AC 化石燃料的燃烧等 CO2+H2O═H2CO3 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH ACD
【解析】
(1)自来水厂生产自来水时,常用的净水方法有沉淀、过滤、吸附、消毒等,没有蒸馏,故填ABC。
(2)“氧气同学”不能从甲处通过,说明甲处放的物质可以与氧气反应,A.木炭 B.水 C.铁 D.浓硫酸中,木炭、铁能与氧气反应,故填AC。
(3)①产生二氧化碳的一种途径是化石燃料的燃烧等,故填化石燃料的燃烧等;
②海水吸收二氧化碳时,二氧化碳与水反应生成碳酸,故反应的化学方程式写为:CO2+H2O═H2CO3。
(4)①反应中,分离室中氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,发生的复分解反应是氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,故化学反应方程式写为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
②A、过程中二氧化碳能被氢氧化钠溶液吸收,碳酸钙分解生成二氧化碳和氧化钙,因此该过程不能实现CO2零排放,选项错误;
B、过程中,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,因此该过程至少发生了4个化学反应,选项正确;
C、过程中氢氧化钠和氧化钙都可以循环利用,选项错误;
D、通过过滤能够把碳酸钙从液体中分离出来,因此分离室中分离物质的操作是过滤而不是蒸发,选项错误,故填ACD。

【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
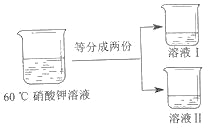
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。