题目内容
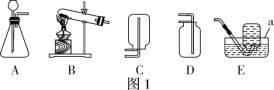
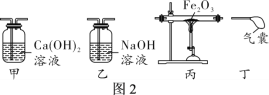
【题目】(2018邢台育才中学一模)某兴趣小组利用如图所示装置(夹持仪器省略),用锌粒与足量稀硫酸反应制取氢气,并还原氧化铜。
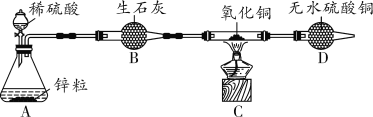
(实验1)小组同学先检查装置的气密性,然后称取4.0 g氧化铜于装置C的硬质玻璃管中,并开始实验。
(1)装置A中反应的化学方程式为_____;无水硫酸铜是白色粉末,当C中固体由黑色逐渐变为红色时,D中固体变为蓝色,此现象说明C装置中反应生成了_____(填写物质名称或化学式)。
(2)实验时,应先使A中反应进行一段时间,并在装置D的末端检验气体纯度,再点燃C处酒精灯。这样操作的原因是_____。
(提出问题)实验结束后,C中固体的成分是什么?
(作出猜想)猜想一:Cu;猜想二:Cu和CuO。
(实验2)取出反应后C中固体,称量,质量_____(选填“>”“=”或“<”)3.2 g。得出结论:猜想二正确。
(实验3)为进一步证明(实验2)所得结论是否正确,小组同学用试管取少量C中反应后的固体,向其中滴加_____,振荡,观察到的现象为_____。也得出结论:猜想二正确。
(交流反思)反应结束后,C中固体内还有氧化铜的原因有两个:一是加入的氧化铜没有完全反应;二是反应结束时操作不规范。反应结束时,会造成C中固体内有氧化铜的不规范操作是_____。
【答案】Zn+H2SO4=ZnSO4+H2↑ 铜和水(或Cu和H2O) 排尽装置内的空气 > 稀盐酸(或稀硫酸) 固体部分溶解,溶液逐渐变成蓝色 先停止装置A中的反应,再熄灭酒精灯
【解析】
【实验1】(1)锌与稀硫酸反应生成氢气和硫酸锌,当C中固体由黑色变为红色时,说明黑色的氧化铜被还原为铜,D中白色固体变为蓝色,说明C中反应有水生成。(2)可燃性气体与空气混合时加热易发生爆炸,所以实验时,先使A中反应进行一段时间,并在装置D的末端检验气体纯度,以排尽装置内的空气。【实验2】氢气还原氧化铜生成铜和水,若氢气将4.0g氧化铜全部还原为铜,则生成铜的质量为3.2g,由于猜想二成立,即C中固体为Cu和CuO,则氢气没有将4.0g氧化铜全部还原为铜,则C中剩余固体的质量大于3.2g。【实验3】检验C中固体成分即为检验CuO是否存在,可向固体中滴加稀盐酸或稀硫酸,观察到固体部分溶解,溶液逐渐变成蓝色,可证明固体中有CuO,从而也能得出猜想二成立。【交流反思】铜单质在有氧气且加热的条件下会被氧化为氧化铜,所以若先停止装置A中的反应,再熄灭酒精灯,会使C中固体含有CuO。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10 g | 3.0 g |
第二次加入10 g | 2.0 g |
第三次加入10 g | 1.0 g |
第四次加入10 g | 0.6 g |
请计算:
(1)4.0 g石灰石样品中碳酸钙的质量是_____g。
(2)求稀盐酸的溶质质量分数。
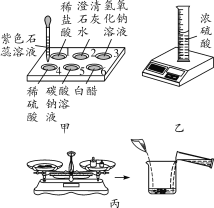
【题目】不同类别的物质之间存在着一定的关系,如图所示(“——”表示相连的两种物质能发生反应,“→”表示某种物质可以转化为另一种物质)。
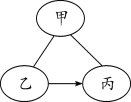
(1)稀盐酸、氢氧化钠溶液、碳酸钠溶液之间的变化关系如图所示,回答下列问题:
①甲物质能使紫色石蕊溶液变成_____色。
②写出“甲——乙”的化学方程式_____。
(2)某化学小组为了验证甲、乙、丙物质之间关系,进行实验并得出结论:
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,向溶液中滴加稀盐酸 | 产生气泡 | 此氢氧化钠溶液已变质 |
该小组同学对意外观察到气泡现象产生兴趣,对该变质的NaOH溶液展开了探究。
(提出问题)该NaOH溶液是全部变质还是部分变质呢?
(猜想与假设)
猜想1:NaOH溶液部分变质;
猜想2:NaOH溶液全部变质。
(查阅资料)CaCl2溶液呈中性。
下面是甲同学设计的实验方案,通过明显现象验证了一种猜想。请帮助甲同学完成下表中的实验方案及相关问题。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡 | _____ | 说明原溶液中一定含有碳酸钠 |
②_____ | _____ | 说明原溶液中一定含有氢氧化钠 |
(实验结论)该氢氧化钠溶液_____(填“部分”或“全部”)变质。
(反思评价)在上述(实验探究)中,乙同学认为用适量的氢氧化钙溶液代替氯化钙溶液也能探究出氢氧化钠溶液变质的程度。甲同学认为乙同学的说法不合理,这样会对氢氧化钠的检验造成干扰。请你用化学方程式表示出甲同学的理论依据_____。