题目内容
【题目】某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10 g | 3.0 g |
第二次加入10 g | 2.0 g |
第三次加入10 g | 1.0 g |
第四次加入10 g | 0.6 g |
请计算:
(1)4.0 g石灰石样品中碳酸钙的质量是_____g。
(2)求稀盐酸的溶质质量分数。
【答案】(1)3.4;(2)7.3%
【解析】
解:分析表格数据可知,每10 g稀盐酸可与1 g碳酸钙恰好完全反应
设10 g稀盐酸中HCl的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1 g x
![]() =
=![]() x=0.73 g
x=0.73 g
稀盐酸的溶质质量分数为![]() ×100%=7.3%
×100%=7.3%
答:稀盐酸的溶质质量分数为7.3%。

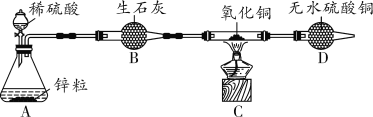
【题目】(2018徐州节选)为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:________________________。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气; 猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
(查阅资料)(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO![]() Cu+H2O
Cu+H2O
(实验探究)师生设计了如图装置进行实验(部分仪器省略),请完成下列表格。

主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是______________ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显显现 | 猜想________正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | / | / |
④冷却,将A中液体用水稀释 | A中液体变为______色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是__________________________________。
(2)请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+________。
CuSO4+SO2↑+________。
(反思拓展)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是______________________。