题目内容
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:

Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。

请回答问题:
(1)反应器中发生反应的化学方程式为 ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 。
(4)操作A的名称是 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 和 ;
(5)洗涤过碳酸钠晶体最好选用 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 和 ;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。

【实验步骤】:① ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① 、④ ;
(8)实验中,水的作用是 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 (填化学式);
(9)实验中, ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ;
(12)量筒中长导管的作用是 ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ;
(14)经过讨论,小组同学一致认为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3·3H2O2的质量分数? 。(只需给出简要的方案)
(1)2Na2CO3+3H2O2=2Na2CO3·3H2O2 (2)防止过碳酸钠分解,影响产量和产率
(3)过碳酸钠在NaCl溶液中溶解度较小,易析出晶体
(4)过滤 玻璃棒 漏斗 (5)B (6)NaCl Na2CO3(或H2O2)
(7)检查气密性 不再产生气体时 (8)溶解过碳酸钠,利于其分解 MnO2(或CuO)
(9)A(2分)
(10)95.0%
(11)滴入的水占据了锥形瓶内的体积,使得O2体积偏大
(12)起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸)
(13)不正确,装置中原有空气和生成的O2等体积代换 (注:理由叙述不正确不给分)
(14)93.6%(或93.5%)
(15)想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定)(其他合理答案也可得分)
【解析】
试题分析:(1)根据制备过碳酸钠的工艺流程图可知,反应器中的反应物是Na2CO3溶液和H2O2溶液,生成物是制备的过碳酸钠,故反应的化学方程式为2Na2CO3+3H2O2=2Na2CO3·3H2O2。
(2)根据资料卡片可知,过碳酸钠不稳定,受热、遇水易分解,故为了防止过碳酸钠分解,影响产量和产率,在生产中,反应及干燥均需在较低温度下进行。
(3)根据题意分析,加入较多的NaCl,能使过碳酸钠晶体析出,说明相同温度下,过碳酸钠在NaCl溶液中的溶解度,要比在水中的溶解度小,溶液容易达到过饱和状态而有晶体析出。
(4)根据图示可知,操作A是将母液和不溶于母液的晶体分离开来的操作,故为过滤;过滤需要过滤器,自然需要漏斗,同时还需要玻璃棒引流。
(5)由于过碳酸钠不稳定,遇水易分解,故洗涤过碳酸钠晶体时不能涉及到水,所以最好选用无水酒精,故选B。
(6)根据图示可知,为了能使过碳酸钠晶体析出,向溶液中加入了大量的NaCl,故母液中一定含有NaCl,此外,该母液是Na2CO3的母液,即为Na2CO3的饱和溶液,故溶液中一定含有Na2CO3。
(7)①根据题意,要利用该装置制取并收集氧气,故需要装置不能漏气,所以反应前要检查装置的气密性;④当A中不再产生气体时,说明过碳酸钠已完全反应,则不需再加水。
(8)根据题意,过碳酸钠不稳定,遇水易分解,所以加水能促进其分解,同时水能溶解过碳酸钠,增大其与催化剂的接触面,增加反应的速率;
根据题意,黑色粉末能加快过碳酸钠的分解速率,而其自身质量和化学性质在反应前后均不变,故该黑色粉末是该反应的催化剂,故可能是MnO2(或CuO)。
(9)当有气泡产生时,说明反应已经开始,故要立即收集。故选A
(10)根据公式计算,过碳酸钠分解产生氧气质量=224mL×10—3×1.43g/L—1 = 0.32g;
设过碳酸钠样品中2Na2CO3·3H2O2的质量为x
2(2Na2CO3·3H2O2) =4Na2CO3 + 6H2O + 3O2↑
628 96
x 0.32g
628:96=x:0.32g
解得x=2.09g
则样品中,2Na2CO3·3H2O2的质量分数=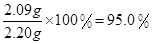
(11)由于滴入的水占据了锥形瓶内一定的体积,故使得O2体积偏大。
(12)根据资料卡片可知,过碳酸钠分解反应过程中会放出热量,故生成的氧气会受热膨胀,而当反应结束温度降低至室温时,装置内压强减小,而此时由于长导管的开口已在水面以上,故可防止倒吸。
(13)不正确,因为装置中原有的空气虽在反应开始时被排入量筒,但由于压强的原因,最后装置中仍会保留一部分生成的氧气,故相当于装置中原有空气和生成的O2等体积代换。
(14)根据资料可知,2(2Na2CO3·3H2O2) = 4Na2CO3 + 6H2O + 3O2↑,故完全反应后的溶液中的溶质是Na2CO3,所以将装置A中剩余物过滤,洗涤滤渣(催化剂),并将洗涤液并入滤液蒸发,得到的1.39g无水固体即为Na2CO3晶体的质量。
设过碳酸钠样品中2Na2CO3·3H2O2的质量为x
2(2Na2CO3·3H2O2) =4Na2CO3 + 6H2O + 3O2↑
628 424
x 1.39g
628:424=x:1.39g
解得x=2.06g
则样品中,2Na2CO3·3H2O2的质量分数=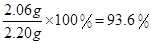
(15)根据资料卡片可知,过碳酸钠具有碳酸钠的性质,故可加酸和其反应,并想办法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算。
考点:饱和溶液和不饱和溶液,过滤,书写化学方程式,实验探究物质的组成成分以及含量,盐的化学性质,根据化学反应方程式的计算
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 生活中用到各种漂白剂.化学课上,老师带来一种常用作漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).
生活中用到各种漂白剂.化学课上,老师带来一种常用作漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).【提出猜想】该漂白剂肯定不是
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢.
②过氧化氢常温下能缓慢分解,实验室用过氧化氢制取氧气的化学方程式为
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 步骤1 | 取2g白色固体放入试管中,加入5mL水,充分振荡. | 液体浑浊,有持续的细小气泡冒出. | |
| 步骤2 | 向步骤1的试管中继续滴加无色酚酞. | 无色酚酞变红. | |
| 步骤3 | 继续滴加 |
该漂白剂的成分不是过碳酸钠. |
 生活中用到各种漂白剂.化学课上,老师带来一种常用作氧系漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).
生活中用到各种漂白剂.化学课上,老师带来一种常用作氧系漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(右图).【提出猜想】该漂白剂肯定不是
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,迅速分解生成碳酸钠和过氧化氢.
②过氧化氢常温下不稳定,实验室用过氧化氢制取氧气的化学方程式为
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 步骤1 | 取2g白色固体放入试管中,加入20mL水,充分振荡. | 液体浑浊, 有持续的细小气泡冒出. |
|
| 步骤2 | 静置,取步骤1的试管上层清液少许,滴加无色酚酞. | 无色酚酞变红. | |
| 步骤3 | 该消毒剂的成分不是过碳酸钠. |
 生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).
生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3?3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).【提出猜想】该漂白剂肯定不是
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢.
②过氧化氢常温下不稳定,实验室用过氧化氢制取氧气的化学方程式为
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 步骤1 | 取2g白色固体放入试管中,加入5ml水,充分振荡. | 液体浑浊, 有持续的细小气泡冒出. |
|
| 步骤2 | 向步骤1的试管中继续滴加无色酚酞. | 无色酚酞变红. | |
| 步骤3 | 该消毒剂的成分不是过碳酸钠. |

