题目内容
氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O 4NH3+3O2。计算生产34t NH3所需N2的质量。
4NH3+3O2。计算生产34t NH3所需N2的质量。
28t
解析试题分析:根据生成氨气的质量,由反应的化学方程式计算出产生氮气的质量即可
解:设生产34tNH3所需N2的质量的为x
2N2+6H2O 4NH3+3O2
4NH3+3O2
56 68
x 34t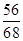 =
=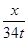
解得x=28t
答:生产34tNH3所需N2的质量为28t
考点:考查根据化学反应方程式的计算

练习册系列答案
相关题目
氧化钙和碳酸钙的固体混合物质量为120克,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质量为84克。则原固体混合物中钙元素的质量分数为
| A.70% | B.20% | C.40% | D.50% |
点燃H2、O2和N2的混合气体20g,充分反应后生成18g水,则剩余的可能是( )
| A.O2和N2的混合气体2g | B.H2和N2的混合气体2g |
| C.H2、O2和N2的混合气体2g | D.2g N2 |
取一定量的氧化铁与氧化铜的混合物,加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应生成盐和水.原混合物中氧元素的质量是( )
| A.6.4g | B.3.2g | C.1.8g | D.1.6g |
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为( )
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑