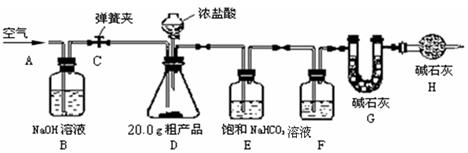
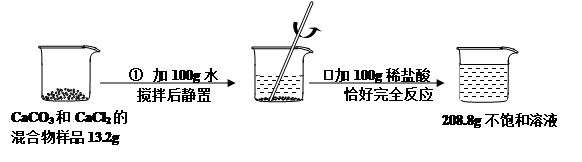
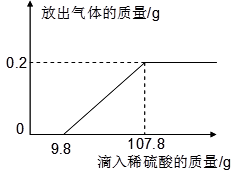
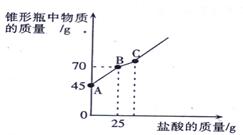
题目内容
为了对海水中的氯化物(假设以NaCl计算)进行成分分析,甲、乙、丙三位同学分别进行实验数据如下,请仔细观察分析,回答下列问题:
(1)两溶液恰好完全反应的是__________的实验。
(2)请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?
| | 甲 | 乙 | 丙 |
| 所取海水样品的质量 /g | 100 | 50 | 50 |
| 加入AgNO3溶液的质量 /g | 50 | 50 | 75 |
| 反应后所得的沉淀物的质量 /g | 1.435 | 1.435 | 1.435 |
(2)请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?
(1)乙 (2)1.17%
(1)由实验甲、乙相比较可知,乙中AgNO3已经完全反应;由实验乙、丙相比较可知,乙中海水中的NaCl已经完全反应了,故乙实验中两溶液恰好完全反应。
(2)解:设50g海水中含氯化钠的质量为x
NaCl + AgNO3===AgCl↓ + NaNO3
58.5 143.5
x 1.435g
x=(58.5×1.435g)/143.5=0.585g
则海水中氯化钠的质量分数为:(0.585g/50g)×100%=1.17%
答:海水中的氯化物(以氯化钠计算)的质量分数是1.17%
(2)解:设50g海水中含氯化钠的质量为x
NaCl + AgNO3===AgCl↓ + NaNO3
58.5 143.5
x 1.435g
x=(58.5×1.435g)/143.5=0.585g
则海水中氯化钠的质量分数为:(0.585g/50g)×100%=1.17%
答:海水中的氯化物(以氯化钠计算)的质量分数是1.17%

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目