题目内容
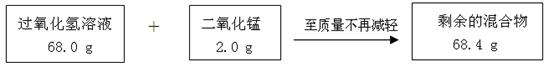
(6分)请根据下图所示的实验过程和提供的数据,试回答下列问题:
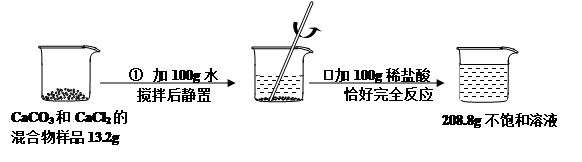
(1)在第②步实验操作中,观察到的一项实验现象是: 。
(2)第①步实验操作后,烧杯中溶液里含有的溶质是(写化学式) 。
(3)计算原混合物样品中CaCl2的质量(写出计算过程,结果精确至0.1g)。

(1)在第②步实验操作中,观察到的一项实验现象是: 。
(2)第①步实验操作后,烧杯中溶液里含有的溶质是(写化学式) 。
(3)计算原混合物样品中CaCl2的质量(写出计算过程,结果精确至0.1g)。
(1)固体物质不断溶解或有气体产生或有气泡冒出(其他合理答案可得分)(1分)
(2)CaCl2(1分)
(3)3.2g
(2)CaCl2(1分)
(3)3.2g
(1)CaCO3与稀盐酸反应生成CO2气体。
(2)CaCO3难溶于水,CaCl2溶于水,故①后所得溶液的溶质为CaCl2。
(3)解:反应中生成CO2的质量为:13.2g+100g+100g-208.8g="4.4g"
设原混合物中CaCO3的质量为x
CaCO3+ 2HCl CaCl2+ H2O + CO2↑
100 44
x 4.4g
100/44 = x/4.4g 解得 x = 10g
原混合物样品中CaCl2的质量为:
13.2g-10g= 3.2g
答:原混合物样品中CaCl2的质量为3.2g。
(2)CaCO3难溶于水,CaCl2溶于水,故①后所得溶液的溶质为CaCl2。
(3)解:反应中生成CO2的质量为:13.2g+100g+100g-208.8g="4.4g"
设原混合物中CaCO3的质量为x
CaCO3+ 2HCl CaCl2+ H2O + CO2↑
100 44
x 4.4g
100/44 = x/4.4g 解得 x = 10g
原混合物样品中CaCl2的质量为:
13.2g-10g= 3.2g
答:原混合物样品中CaCl2的质量为3.2g。

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目