题目内容
(6分)(2012?仙桃)胃溃疡病人要治疗胃酸(主要含稀盐酸)过多症不宜服用含NaHCO3的药片,可服用含Al(OH)3的药片.则:
(1)胃酸与NaHCO3反应的化学方程式为: _________ .
(2)Al(OH)3与胃酸反应生成AlCl3的化学反应类型是 _________ .
(3)在实验室里,将含3.9gAl(OH)3的药片加入到质量分数为3.65%的稀盐酸中,完全反应时所需稀盐酸的质量为多少克?
(1)胃酸与NaHCO3反应的化学方程式为: _________ .
(2)Al(OH)3与胃酸反应生成AlCl3的化学反应类型是 _________ .
(3)在实验室里,将含3.9gAl(OH)3的药片加入到质量分数为3.65%的稀盐酸中,完全反应时所需稀盐酸的质量为多少克?
(1)NaHCO3+HCl═NaCl+H2O+CO2↑;(2)复分解反应;(3)150g
(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
(2)Al(OH)3与胃酸反应,属于化合物与化合物相互交换成分生成另外两种化合物的反应,是复分解反应;
(3)设完全反应时所需稀盐酸的质量为X
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
3.9g 3.65%×X
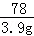 =
=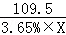
X=150g
答:将含有3.9gAl(OH)3的药片完全反应时所需稀盐酸的质量是150克.
(2)Al(OH)3与胃酸反应,属于化合物与化合物相互交换成分生成另外两种化合物的反应,是复分解反应;
(3)设完全反应时所需稀盐酸的质量为X
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
3.9g 3.65%×X
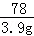 =
=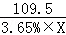
X=150g
答:将含有3.9gAl(OH)3的药片完全反应时所需稀盐酸的质量是150克.

练习册系列答案
相关题目