题目内容
【题目】化学与生活密切相关。“洁厕灵”和“84消毒液”是两种常见的生活用品。两者混合会产生有毒的氯气,其反应的方程式为: NaClO+2HCl=NaCl+Cl2↑+X。请回答以下问题:
(1)X是由________构成的物质(填“分子”或“原子”或“离子”)。
(2)NaCl中Na+的结构示意图为_______________。
(3)标出 NaClO中氯元素的化合价_____________。
【答案】分子 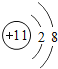
![]()
【解析】
(1)根据反应的化学方程式NaClO+2HCl═NaCl+X+Cl2↑,反应物中钠、氯、氢、氧原子个数分别为1、3、2、1,反应后的生成物中钠、氯、氢、氧原子个数分别为1、3、0、0,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O,水由水分子构成;故填:分子;
(2)钠离子核内有11个质子,核外有2个电子层,第一层上有2个电子,第二层上有8个电子,钠离子的结构示意图为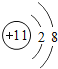 ,故填:
,故填: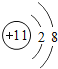 ;
;
(3)NaClO中氯元素的化合价为+1价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故NaClO中氯元素的化合价显+1价可表示为:![]() ,故填:
,故填:![]() 。
。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
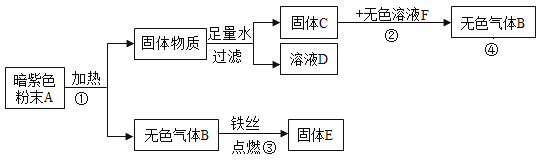
新黄冈兵法密卷系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化作用呢?于是进行了以下探究。
(猜想)Ⅰ.CuO不是催化剂,也不参加反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应生成O2,反应前后质量和化学性质发生改变;
Ⅲ. CuO是反应的催化剂,反应前后_________________。
(实验及结论)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
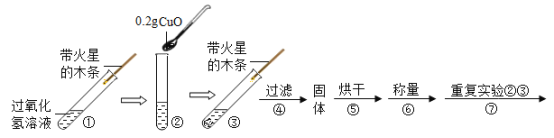
(1)填写下表:
步骤③现象 | 步骤⑥ | 步骤⑦现象 | 结论 |
溶液中有气泡冒出,带火星木条复燃 | 称量所得固体质量为 ____________g | 溶液中有气泡冒出,_____________ | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立。 |
(表达与交流)过氧化氢被CuO催化分解放出氧气的化学反应方程式为_____________。
(反思与拓展)
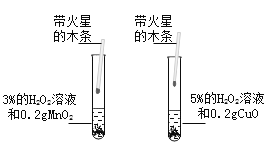
(1)甲同学为研究催化剂种类对催化效果的影响,用等量的两份过氧化氢溶液设计了以下实验,大家认为该方案不可行,其原因是_________。
(2)以下有关催化剂的说法正确的是_____________(填序号)。
①二氧化锰是催化剂
②某些化学反应可以有多个催化剂
③一种物质可能作为多个反应的催化剂
④所有化学反应都需要催化剂
⑤催化剂只能加快化学反应速率
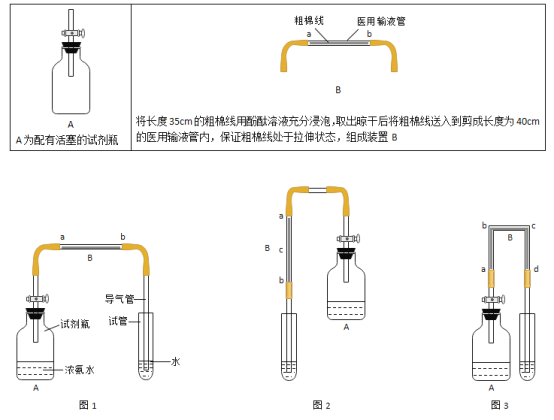
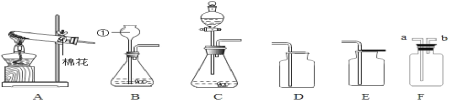
【题目】化学实验是学习化学的基础,请根据下列装置图回答问题。
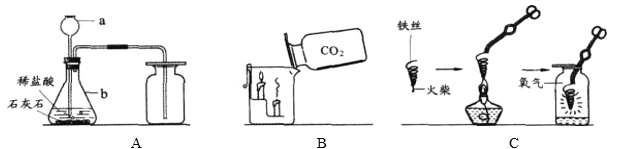
(1)写出仪器a、b的名称:a_____;b_____。
(2)写出A图中产生气体的化学方程式_____。
(3)B图中,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,_____先灭,说明二氧化碳具有_____、_____和_____性质。这一性质在实际生活中的应用为_____。
(4)C图中螺旋状铁丝的末端系一根火柴的作用是_____。
(5)小明按C图实验时,集气瓶炸裂了,其可能的原因是_____。
(6)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录。请你分析回答:
物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | _____ |
铁丝在氧气中燃烧产生火星四射的原因是_____。
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如下,请计算:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸的累计加入量/g | 40.0 | 80.0 | 120.0 | 160.0 |
产生CO2的总质量/g | 2.2 | m | 5.5 | 5.5 |
(1)m=_____;
(2)15g大理石样品与稀盐酸反应最多产生二氧化碳的质量是_____g;
(3)15g石灰石样品与盐酸恰好完全反应时,消耗的盐酸质量为_____g;
(4)在下图中画出生成气体的质量与加入稀盐酸的质量的关系_____。
(5)石灰石样品中碳酸钙的质量分数是多少?_____(写出计算过程,结果保留一位小数)