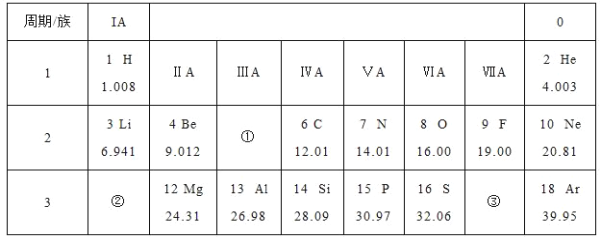
题目内容
【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用15g石灰石样品,把160g稀盐酸平均分4次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后实验数据如下,请计算:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸的累计加入量/g | 40.0 | 80.0 | 120.0 | 160.0 |
产生CO2的总质量/g | 2.2 | m | 5.5 | 5.5 |
(1)m=_____;
(2)15g大理石样品与稀盐酸反应最多产生二氧化碳的质量是_____g;
(3)15g石灰石样品与盐酸恰好完全反应时,消耗的盐酸质量为_____g;
(4)在下图中画出生成气体的质量与加入稀盐酸的质量的关系_____。
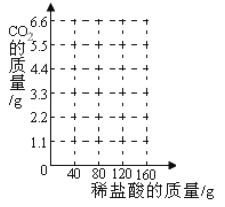
(5)石灰石样品中碳酸钙的质量分数是多少?_____(写出计算过程,结果保留一位小数)
【答案】4.4 5.5 100 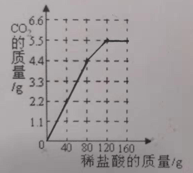 83.3%
83.3%
【解析】
(1)通过第三次和第一次比较,盐酸是第一次的三倍,而二氧化碳不是第一次的三倍,说明第三次碳酸钙已经完全反应。40g盐酸生成二氧化碳2.2g,80g盐酸生成二氧化碳都是第一次的2倍,即m=4.4;
(2)分析表中数据可知,15g大理石样品与稀盐酸反应最多产生碳的质量是5.5g;
(3)分析表中数据可知,生成1.1g二氧化碳需要消耗盐酸的质量为20g,15g石灰石样品与盐酸恰好完全反应时,需要盐酸的质量为20g![]() 5=100g;
5=100g;
(4)根据表中数据,生成气体的质量与加入稀盐酸的质量的关系如图:

(5)设参加反应碳酸钙的质量为x,
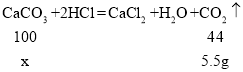
![]() x=12.5g,
x=12.5g,
石灰石样品中碳酸钙的质量分数=![]() 。
。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目