题目内容
【题目】以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
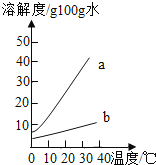
(1)要除去Na2CO3固体中的少量NaHCO3,应采用的物理方法是 (填写编号).
①冷却热饱和溶液 ②蒸发溶剂 ③溶解过滤
(2)已知Na2CO3转化为NaHCO3的反应为Na2CO3+CO2+H2O→2NaHCO3,根据以上信息,要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是 .
(3)40℃时的100g Na2CO3的饱和溶液中含有 g溶质,该溶液的溶质质量分数为 %.(计算结果精确到0.1)
(4)若将30%的碳酸钠溶液100g,稀释到10%,需要加水 mL.
(5)在上述(3)的配制过程中,不需要的仪器是(填序号) .
A.托盘天平 B.100mL量筒 C.25mL量筒 D.250mL烧杯
(6)“水的蒸发”和“水的电解”两个实验中水发生变化的本质区别是(从微观视角分析) .
【答案】(1):②;(2)C;
(3)32.9g,32.9%;(4)200mL;(5)C;
(6))水蒸发时分子间隔变大,水电解是分子发生的变化.
【解析】(1)分析溶解度表可知:Na2CO3的溶解度随温度的升高而升高,且受温度影响较大;NaHCO3的溶解度随温度的升高而升高,但受温度影响变化不大.所以要出去NaHCO3固体中的少量Na2CO3,可将固体溶于水,采用蒸发结晶法,故选:②;
(2)碳酸钠、水和二氧化碳会生成碳酸钠,所以要除去NaHCO3饱和溶液中的少量Na2CO3,应采用的化学方法是通入二氧化碳,故选:C;
(3)40℃时碳酸钠的溶解度是49g,所以100gNa2CO3的饱和溶液中含有32.9g溶质,该溶液的溶质质量分数为32.9%;
(4)![]() ﹣100g=200g,合200mL;
﹣100g=200g,合200mL;
(5)在上述(3)的配制过程中,不需要的仪器是25mL的量筒,故选:C;
(6))“水的蒸发”和“水的电解”两个实验中水发生变化的本质区别是:水蒸发时分子间隔变大,水电解是分子发生的变化.

 阅读快车系列答案
阅读快车系列答案【题目】从分子的角度分析并解释下列事实,不正确的是
选项 | 事 实 | 解 释 |
A | 碘酒是混合物 | 由不同种分子构成 |
B | 端午时节粽飘香 | 分子在不断运动着 |
C | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |
A. A B. B C. C D. D
