题目内容
【题目】物质甲、乙、丙为初中化学常见物质,其关系如图所示(“→”表示一种物质经过一步反应转化为另一种物质;“---”表示相连物质间转化关系特定,部分反应物、生成物及反应条件已略去)。
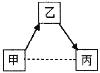
(1)若甲是一种常见的温室气体,乙是纯碱
①若甲与丙可以反应,则丙可能是____________(写化学式,下同)。
②若甲与丙可以相互转化,则丙可能是_____________。
(2)若甲可以转化为丙,丙为白色难溶物,且反应皆为复分解反应
①若甲、乙、丙含相同的原子团,甲为常见的稀酸,乙为蓝色溶液,则甲转化为乙还需的另一种反应物是__________(填名称),丙的化学式是____________。
②若甲、乙、丙含相同的金属元素,甲为常见的碱,相对分子质量为74,则甲的用途是______,乙转化为丙的化学方程式为________________________________________________(写一个)。
【答案】H2O CaCO3 氢氧化铜或氧化铜 BaSO4 改良酸性土壤或做建筑材料 CaCl2+Na2CO3=CaCO3↓+2NaCl
【解析】
(1)若甲是一种常见的温室气体,则甲是二氧化碳,乙是纯碱:①若二氧化碳与丙可以反应,纯碱又可以转化为丙,则丙是水或氢氧化钠,化学式为:H2O(合理即可);
②甲是二氧化碳,乙是纯碱,若甲与丙可以相互转化,丙可以是碳酸钙,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,化学式为:CaCO3;
(2)①若甲可以转化为丙,丙为白色难溶物,且反应皆为复分解反应,则:①若甲为常见的酸,甲、乙、丙含相同的原子团,丙溶液为蓝色,所以甲是硫酸,乙是硫酸铜,丙是硫酸钡沉淀;所以甲转化为乙还需的另一种反应物是氢氧化铜或氧化铜;
②若甲为常见的碱,且相对分子质量为74,所以甲是氢氧化钙,可用于改良酸性土壤、做建筑材料等;甲、乙、丙含相同的金属元素,所以乙可以是氯化钙等可溶性钙盐,丙是碳酸钙,所以乙生成丙的反应是氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
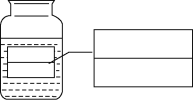
暑假衔接培优教材浙江工商大学出版社系列答案【题目】氢氧化钠和氢氧化钙是两种常见的碱。李晓同学将两种碱的溶液分别装入试管A、B中,并进行了如图所示的三组实验:
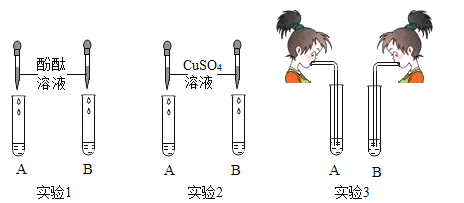
(1)实验l中,两支试管的溶液都变成______色。
(2)实验2中,若B盛装的是NaOH溶液,发生反应的化学方程式为______。
(3)实验3中,李晓同学向两支试管吹气,A中有白色沉淀生成,B中无现象,为了探究吹气后B中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
实验和结论:
实验 | 实验现象 | 结论 |
取B中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 | ______ | 猜想3成立 |
反思与评价:
老师评价李晓得出的结论不正确,是因为猜想______(填数字)也会产生相同的现象,如果要验证“猜想3成立”,必须要换试剂,将Ca(OH)2换成______溶液。