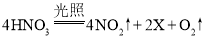题目内容
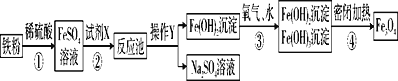
【题目】海水是巨大的资源宝库。利用海水制取碳酸钠和金属镁的流程如图所示(部分物质和过程省略)
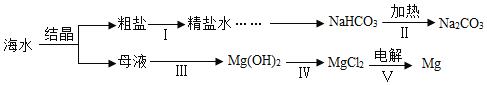
(1)如表为氯化钠在不同温度时的溶解度。请结合表中数据回答问题:
温度/℃ | 30 | 50 | 70 | 100 |
溶解度/g | 36.3 | 37.0 | 37.8 | 39.8 |
从海水中获取粗盐,宜选用______(选填“蒸发结晶”或“降温结晶”)。
(2)粗盐提纯时,每步操作都会用到的一种玻璃仪器是______(填仪器名称)。
(3)步骤Ⅱ发生反应的化学方程式为______。
(4)母液中含有MgCl2,步骤Ⅲ向母液中加入生石灰,发生反应的化学方程式为______。
(5)步骤Ⅳ中Mg(OH)2与盐酸的反应______中和反应(选填“是”或“不是”)。
【答案】蒸发结晶 玻璃棒 ![]() CaO+H2O=Ca(OH)2或Ca(OH)2+MgCl2=Mg (OH)2↓+CaCl2 是
CaO+H2O=Ca(OH)2或Ca(OH)2+MgCl2=Mg (OH)2↓+CaCl2 是
【解析】
碳酸氢钠在加热的条件下分解为碳酸钠、水和二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙。
(1)氯化钠的溶解度受温度的影响不大,故从海水中获取粗盐,宜选用蒸发结晶。
(2)在粗盐提纯中,从溶解到过滤、蒸发操作,都要用到的玻璃仪器是玻璃棒。
(3)步骤Ⅱ发生的反应是碳酸氢钠在加热的条件下分解为碳酸钠、水和二氧化碳,反应的化学方程式为![]() 。
。
(4)生石灰放入水中,氧化钙与水反应生成氢氧化钙;氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为CaO+H2O=Ca(OH)2或Ca(OH)2+MgCl2=Mg (OH)2↓+CaCl2。
(5)氢氧化镁是一种碱,盐酸是一种酸,氢氧化镁和盐酸反应生成氯化镁和水,故步骤Ⅳ中Mg (OH)2与盐酸的反应是中和反应。

 阅读快车系列答案
阅读快车系列答案【题目】20°C时,某物质溶解于水的实验数据如下表。则下列叙述正确的是( )
实验序号 | 水的质量/g | 加入该物质的质量/g | 剩余未溶解固体的质量/g |
① | 10 | 2 | 0 |
② | 10 | 3 | 0 |
③ | 10 | 4 | 0.4 |
④ | 10 | 5 | 1.4 |
A.溶液质量由大到小的顺序为④>③>②>①
B.20℃时10g饱和溶液溶有3.6g该物质
C.20℃时10g水最多溶解3.6g该物质
D.①所得溶液的溶质质量分数为20%