题目内容
【题目】实验室配制50g溶质质量分数为6%的氯化钠溶液。下列说法中错误的是( )
A.实验步骤为计算、称量、量取、溶解、装瓶
B.需用托盘天平称取3g氯化钠固体,用规格为100mL的量筒量取47mL蒸馏水
C.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
D.把配制好的氯化钠溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数)
【答案】B
【解析】
![]()
A、实验室配制50g溶质质量分数为6%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶存放,故A正确;
B、应称取氯化钠![]() ,所需水的质量为
,所需水的质量为![]() (合47mL),应用规格为50mL的量筒量取47mL蒸馏水,故B不正确;
(合47mL),应用规格为50mL的量筒量取47mL蒸馏水,故B不正确;
C、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率,故C正确;
D、把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,标签上写明药品名称、溶质质量分数等,故D正确。故选B。

 名校课堂系列答案
名校课堂系列答案【题目】在下表栏目空格内,填写正确的名称、化学式、类别。
序号 | (1) | (2) | (3) | (4) | (5) |
名称 | 硝酸 | _____ | 氯气 | _____ | 氯化铵 |
化学式 | |
| _____ |
|
|
类别 | 酸 | 氧化物 | 单质 | _____ | 盐 |
加点元素化合价 | _____ | +6 | 0 | +3 | _____ |
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法错误的是
物质 | a | b | c | d |
反应前质量(g) | 10 | 10 | 10 | 2 |
反应后质量(g) | 待测 | 2 | 21 | 2 |
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3g
【题目】某校化学兴趣小组的同学在实验室整理化学药品时,发现一瓶金属铬。为了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,他们进行了如下探究活动:
(查阅资料)铬(Cr)是银白色金属,在空气中其表面能形成致密的氧化膜。
(提出假设)考虑到铝的活动性比铜强,提出了以下三种假设:
假设①:![]() ;
;
假设②:![]() ;
;
假设③:![]() 。
。
(实验过程)取大小相同的Cr、Cu、Al三种金属薄片,用砂纸打磨光亮后,分别放入三支试管中,再分别加入等体积![]() 的稀硫酸。
的稀硫酸。
(实验现象)
金属 | Cr | Cu | Al |
实验现象 | 铬片表面产生气泡缓慢 | 铜片表面无明显变化 | 铝片表面产生气泡较快 |
(实验结论)假设___________成立(填序号)。
(问题与反思)
(1)由上述结论可知,铬可以与硫酸铜溶液发生反应。请写出该反应的化学方程式:________(已知在该反应的生成物中铬元素显![]() 价)。
价)。
(2)小丽提出,按上述实验操作,用硫酸铜溶液代替稀硫酸也能得出三种金属的活动性顺序,你认为_________(填“可行”或“不可行”),理由是________。
【题目】海水是巨大的资源宝库。利用海水制取碳酸钠和金属镁的流程如图所示(部分物质和过程省略)
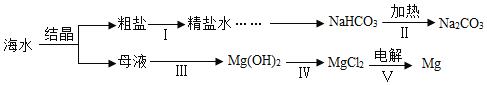
(1)如表为氯化钠在不同温度时的溶解度。请结合表中数据回答问题:
温度/℃ | 30 | 50 | 70 | 100 |
溶解度/g | 36.3 | 37.0 | 37.8 | 39.8 |
从海水中获取粗盐,宜选用______(选填“蒸发结晶”或“降温结晶”)。
(2)粗盐提纯时,每步操作都会用到的一种玻璃仪器是______(填仪器名称)。
(3)步骤Ⅱ发生反应的化学方程式为______。
(4)母液中含有MgCl2,步骤Ⅲ向母液中加入生石灰,发生反应的化学方程式为______。
(5)步骤Ⅳ中Mg(OH)2与盐酸的反应______中和反应(选填“是”或“不是”)。