题目内容
80克锌粒可以跟200g 硫酸溶液恰好完全反应.计算:
(1)反应生成氢气多少克?
(2)这种硫酸溶液中溶质的质量分数是多少?
(3)100g 这种硫酸稀释成20%的硫酸,需加水多少克?
(1)反应生成氢气多少克?
(2)这种硫酸溶液中溶质的质量分数是多少?
(3)100g 这种硫酸稀释成20%的硫酸,需加水多少克?
考点:根据化学反应方程式的计算,用水稀释改变浓度的方法,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据题中的反应原理写出硫酸和锌反应的方程式,然后根据题中的比例关系和所给的数据列出比例关系解出需要的量;
(2)根据反应计算出80g恰好完全反应消耗硫酸的质量,利用溶质质量分数公式计算稀硫酸溶液的质量分数;
(3)加水稀释,稀释前后溶质质量不变.
(2)根据反应计算出80g恰好完全反应消耗硫酸的质量,利用溶质质量分数公式计算稀硫酸溶液的质量分数;
(3)加水稀释,稀释前后溶质质量不变.
解答:解:设反应放出氢气质量为x,消耗硫酸质量为y
Zn+H2SO4 =ZnSO4 +H2↑
65 98 2
80g y x
=
=
x=2.5g
y=120.6g
这种硫酸溶液中溶质的质量分数是
×100%=60.3%
设稀释成质量分数为20%的稀硫酸,需加入水质量为a
设稀释成质量分数为20%的稀硫酸,需加入水质量为a
200g×60.3=(200g+a)×20%
a=201.5g
答案:
(1)反应生成氢气2.5克
(2)这种硫酸溶液中溶质的质量分数是60.3%
(3)需加水201.5克
Zn+H2SO4 =ZnSO4 +H2↑
65 98 2
80g y x
| 65 |
| 80g |
| 98 |
| y |
| 2 |
| x |
x=2.5g
y=120.6g
这种硫酸溶液中溶质的质量分数是
| 120.6g |
| 200g |
设稀释成质量分数为20%的稀硫酸,需加入水质量为a
设稀释成质量分数为20%的稀硫酸,需加入水质量为a
200g×60.3=(200g+a)×20%
a=201.5g
答案:
(1)反应生成氢气2.5克
(2)这种硫酸溶液中溶质的质量分数是60.3%
(3)需加水201.5克
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
相关题目
下列物质性质的描述中,属于化学性质的是( )
| A、甲烷可以在空气中燃烧 |
| B、小苏打是白色粉末状晶体,能溶于水 |
| C、二氧化碳密度比空气大 |
| D、银是银白色固体,具有良好的延展性 |

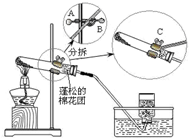 某同学“高锰酸钾制取氧气”的实验过程如下:
某同学“高锰酸钾制取氧气”的实验过程如下: 实验室要配制50g溶质质量分数是10%的氯化钠溶液,有如下步骤:
实验室要配制50g溶质质量分数是10%的氯化钠溶液,有如下步骤: