题目内容
将7g粗锌(杂质不溶于水且与稀硫酸不反应),加入到盛有93.7g稀硫酸的烧杯中,恰好完全反应后,称得烧杯内物质的总质量为100.5g.试计算:
(1)生成氢气的质量为 克;
(2)反应后所得溶液中溶质的质量分数(精确到0.1%).
(1)生成氢气的质量为
(2)反应后所得溶液中溶质的质量分数(精确到0.1%).
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)依据质量守恒定律的有关知识可以利用反应前后物质的质量差求出生成的氢气的质量;
(2)根据化学方程式和氢气的质量求出锌的质量和生成的硫酸锌的质量,进而求质量分数.
(2)根据化学方程式和氢气的质量求出锌的质量和生成的硫酸锌的质量,进而求质量分数.
解答:解:(1)由质量守恒定律定律可知该反应生成的氢气质量是:7g+93.7g-100.5g=0.2g;
故填:0.2;
(2)设锌粒中纯锌的质量为x,反应生成ZnSO4的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
=
=
x=6.5g,y=16.1g
粗锌中杂质的质量为:7g-6.5g=0.5g
反应后所得溶液中溶质的质量分数:
×100%=16.1%
答:反应后所得溶液中溶质的质量分数为16.1%.
故填:0.2;
(2)设锌粒中纯锌的质量为x,反应生成ZnSO4的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.2g |
x=6.5g,y=16.1g
粗锌中杂质的质量为:7g-6.5g=0.5g
反应后所得溶液中溶质的质量分数:
| 16.1g |
| 100.5g-0.5g |
答:反应后所得溶液中溶质的质量分数为16.1%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
化学与日常生活和工农业生产联系紧密,下列说法不正确的是( )
| A、喝牛奶补充蛋白质 |
| B、用熟石灰来区分氯化铵和氯化钾 |
| C、用灼烧的方法鉴别羊毛和涤纶 |
| D、通过食用海产品,加碘盐预防贫血 |

 化学是研究物质的组成、结构、性质以及变化规律的科学.通过近一年的学习,对于水,你一定很熟悉,请回答下面的问题:
化学是研究物质的组成、结构、性质以及变化规律的科学.通过近一年的学习,对于水,你一定很熟悉,请回答下面的问题: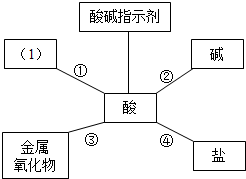 构建知识网络能帮助我们理解知识间的内在联系,请分析以下知识网络图,回答有关问题.
构建知识网络能帮助我们理解知识间的内在联系,请分析以下知识网络图,回答有关问题. 某化学小组的同学对碳酸氢钠(NaHCO3)的性质进行探究.
某化学小组的同学对碳酸氢钠(NaHCO3)的性质进行探究.
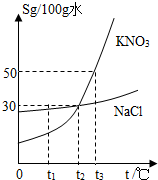 如图是KNO3、NaCl两种固体物质的溶解度曲线.
如图是KNO3、NaCl两种固体物质的溶解度曲线.