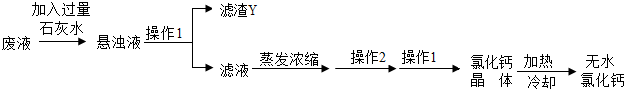
题目内容
某水溶液中含有以下离子中的若干种:K+、Cl-、Ca2+、Zn2+、CO32-、SO42-,现取两份溶液各100mL分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生.根据上述实验,以下有关原溶液的论断不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有沉淀产生.根据上述实验,以下有关原溶液的论断不正确的是( )
| A、Cl-一定存在 |
| B、CO32-和SO42-一定存在,且二者的个数比为1:2 |
| C、Zn2+ 和Ca2+一定不存在 |
| D、100mL溶液中K+的质量不小于2.34g |
考点:常见离子的检验方法及现象,根据化学反应方程式的计算
专题:物质的检验、鉴别与推断
分析:(1)加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
(2)加入足量BaCl2 溶液,得到沉淀6.63g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2+;又根据离子守恒,一定有K+,
综上可知溶液中一定有CO32-和SO42-;,可能有Cl-,一定没有Zn2+、Ca2+
(2)加入足量BaCl2 溶液,得到沉淀6.63g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2+;又根据离子守恒,一定有K+,
综上可知溶液中一定有CO32-和SO42-;,可能有Cl-,一定没有Zn2+、Ca2+
解答:解:
(1)加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
(2)入足量的BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2,剩余4.66g是BaSO4,n(SO42- )=n(BaSO4)=
=0.02mol;BaCO3的质量为m(BaCO3)=6.63g-4.66g=1.97g,n(CO32-)=n(BaCO3)=
=0.01mol;
溶液中含有CO32-、SO42,二者的个数比为2:1;又根据离子守恒,一定有K+,再由电荷守恒,可知c(K+)=0.6 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.6 mol/L,100ml溶液中K+的质量不小于2.34g.
综上可知溶液中一定有K+、CO32-和SO42-,可能有Cl-,一定没有Zn2+、Ca2+
答案:AC.
(1)加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
(2)入足量的BaCl2 溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2,剩余4.66g是BaSO4,n(SO42- )=n(BaSO4)=
| 4.66g |
| 233g/mol |
| 1.97g |
| 197g/mol |
溶液中含有CO32-、SO42,二者的个数比为2:1;又根据离子守恒,一定有K+,再由电荷守恒,可知c(K+)=0.6 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.6 mol/L,100ml溶液中K+的质量不小于2.34g.
综上可知溶液中一定有K+、CO32-和SO42-,可能有Cl-,一定没有Zn2+、Ca2+
答案:AC.
点评:本题考查了常见阴、阳离子的检验,涉及离子共存、离子反应等都是解题需注意的信息,做题时需要细致分析,题目难度适中.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列衣物所使用的主要材料属于合成纤维的是( )
A、 纯棉夹克 |
B、 羊绒围巾 |
C、 腈纶上衣 |
D、 丝绸衣服 |
镁是一种用途广泛的金属材料,目前使用的镁主要是从海水中提取的.其主要流程如图:上述转化过程中未涉及到的基本反应类型是( )

| A、分解反应 | B、化合反应 |
| C、置换反应 | D、复分解反应 |
根据你的生活经验判断,下列做法错误的是( )
| A、用生石灰作食品干燥剂 |
| B、用极细的铁粉作食品脱氧剂 |
| C、铁制品常涂油漆防锈 |
| D、用燃着的火柴检验煤气是否泄露 |
实验室里几种物质在互相谈论着,你认为它们的叙述中属于化学变化的是( )
| A、试管:同学们不爱惜我,我被摔碎了 |
| B、铁钉:好难受啊,我在潮湿空气中生锈了 |
| C、灯泡:我通电后发光了,给学生带来光明 |
| D、蜡烛:我受热就会熔化 |
下列对实验结果的分析中,错误的是( )
| A、配制食盐溶液时,如果量取水时俯视读数,则所取水的体积偏小 |
| B、点燃氢气时发生爆炸,可能是因为没有检验氢气的纯度 |
| C、将带火星的木条伸入集气瓶内,木条复燃,证明瓶内已集满氧气 |
| D、在测定空气中氧气的体积分数时,充分反应后,需将装置冷却至室温再读数,否则测量结果偏低 |
下列实验基本操作中,正确的是( )
A、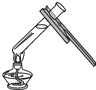 加热液体 |
B、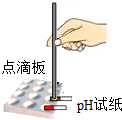 测定溶液 pH |
C、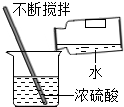 稀释浓硫酸 |
D、 过滤 |
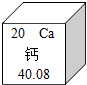 钙元素对人类生命和生活具有重要意义.
钙元素对人类生命和生活具有重要意义.