ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΆ≠ «»ΥάύΉν‘γάϊ”ΟΒΡΫπ τ÷°“ΜΓΘ

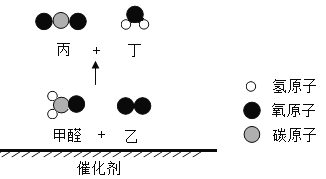
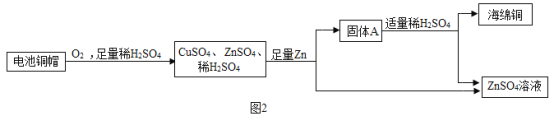
Θ®1Θ©”ΟΓΑ©¹Γ±Ν§Ϋ”Ϋπ τΆ≠ΒΡ–‘÷ ”κ”ΟΆΨΘ®“Σ«σΘΚ–‘÷ ≤Μ÷ΊΗ¥―Γ‘ώΘ©_____ΓΘ
Θ®2Θ©άϊ”ΟΖœΨ…Βγ≥ΊΆ≠Ο±Θ®Κ§CuΓΔZnΘ©÷Τ»ΓΚΘΟύΆ≠Θ®CuΘ©Θ§≤ΔΒΟΒΫΝρΥα–Ω»ή“ΚΘ§÷ς“ΣΝς≥Χ»γœ¬Θ®Ζ¥”ΠΧθΦΰΚΆ≤ΩΖ÷≤ζΈο“―¬‘»ΞΘ©ΘΚ
“―÷ΣΘΚ2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
ΗυΨί…œ ω–≈œΔΘ§Ω…ΆΤΒΟΘΚΙΧΧεAΒΡ≥…Ζ÷ «_____Θ®–¥Μ·―ß ΫΘ©ΘΜΥϋ τ”Ύ_____Θ®―ΓΧνΓΑ¥ΩΨΜΈοΓ±Μρ’ΏΓΑΜλΚœΈοΓ±Θ©Θ§Ιΐ≥ΧΔΌΔΎΔέ÷–ΖΔ…ζΝΥœύΆ§Μ·―ßΖ¥”ΠΘ§ΤδΜ·―ßΖΫ≥Χ ΫΈΣ_____Θ§Ιΐ≥ΧΔΎ÷–Ζ÷άκ≤ΌΉςΒΡΟϊ≥Τ «_____ΘΜ Β―ι “÷–Ϋχ––ΗΟ≤ΌΉςΘ§≥Θ”ΟΒΡ≤ΘΝß“«Τς≥ΐΝΥ…’±≠ΚΆ¬©ΕΖΘ§ΜΙ”–_____ΓΘ
ΓΨ¥πΑΗΓΩ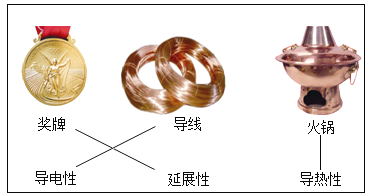 CuΚΆZn ΜλΚœΈο Zn+H2SO4ΘΫZnSO4+H2Γϋ Ιΐ¬Υ ≤ΘΝßΑτ
CuΚΆZn ΜλΚœΈο Zn+H2SO4ΘΫZnSO4+H2Γϋ Ιΐ¬Υ ≤ΘΝßΑτ
ΓΨΫβΈωΓΩ
ΗυΨίΗχ≥ωΒΡΉΣΜ·ΙΊœΒΕ‘”ΠΒΡΙΐ≥ΧΖ÷ΈωΟΩΗωΕ‘”ΠΒΡΈ ΧβΘ§Μρ’Ώ÷±Ϋ”Ζ÷ΈωΟΩΗωΈ ΧβΘ§¥”Ηχ≥ωΒΡ–≈œΔ÷–’“Ε‘”ΠΒΡ–≈œΔΓΘ
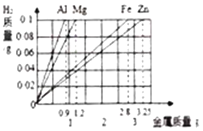
Θ®1Θ©Έο÷ ΒΡ–‘÷ ΨωΕ®Έο÷ ”ΟΆΨΘ§”…”Ύ“Σ«σ–‘÷ ≤Μ÷ΊΗ¥―Γ‘ώΘ§Υυ“‘ΒΟΆΦΈΣΘΚ
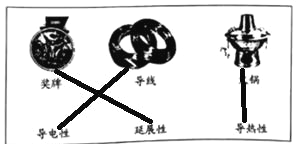
Θ®2Θ©ΙΧΧεAΦ”»κΉψΝΩœΓΝρΥαΖ¥”ΠΒΟΒΫΝρΥα–ΩΚΆΚΘΟύΆ≠Θ§Υυ“‘ΙΧΧεA÷–Κ§”–Ά≠ΚΆ–ΩΘ§Ε‘”ΠΒΡΜ·―ß ΫΈΣ CuΚΆZnΘ§ τ”ΎΜλΚœΈοΘ§Ιΐ≥ΧΔΌΔΎΔέ÷–ΖΔ…ζΝΥœύΆ§Μ·―ßΖ¥”ΠΘ§ΕΦ «–ΩΚΆœΓΝρΥαΖ¥”Π…ζ≥…ΝρΥα–ΩΚΆ«βΤχΘ§Ε‘”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ Zn+H2SO4ΘΫZnSO4+H2ΓϋΘ§Ιΐ≥ΧΔΎ Βœ÷ΝΥΙΧΧεΚΆ“ΚΧεΒΡΖ÷άκΘ§ΗΟΖ÷άκ≤ΌΉς Β―ι «÷–ΈΣΙΐ¬ΥΘΜ Β―ι “÷–Ϋχ––ΗΟ≤ΌΉςΘ§≥Θ”ΟΒΡ≤ΘΝß“«Τς≥ΐΝΥ…’±≠ΚΆ¬©ΕΖΘ§ΜΙ”– ≤ΘΝßΑτΓΘ
Ι ¥πΑΗΈΣΘΚ
Θ®1Θ© ΘΜ
ΘΜ
Θ®2Θ©CuΚΆZnΘΜ ΜλΚœΈοΘΜ Zn+H2SO4ΘΫZnSO4+H2ΓϋΘΜ Ιΐ¬ΥΘΜ ≤ΘΝßΑτΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΡ≥Ά§―ß“ΣΧΫΨΩ»Φ…’ΒΡΧθΦΰΚΆΩ’Τχ÷–―θΤχΒΡΚ§ΝΩΘ§Ϋχ––ΝΥ»γœ¬ Β―ιΘΚ
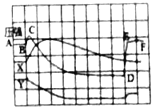
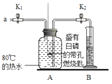
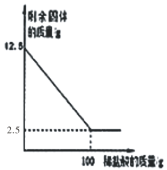
Θ® Β―ιΘ©Θ®“―÷ΣΘΚΑΉΝΉΒΡΉ≈ΜπΒψΈΣ40ΓφΘ©
Β―ιΉΑ÷Ο | Β―ι≤Ϋ÷ηΦΑœ÷œσ |
| ≤Ϋ÷η1Φλ≤ιΉΑ÷ΟΒΡΤχΟή–‘Θ§ΤχΟή–‘ΝΦΚΟΓΘ ≤Ϋ÷η2ΫΪ Δ”–ΑΉΝΉΒΡ¥χΩΉ»Φ…’≥Ή…λ»κAΤΩΘ®Ω’ΤΩΘ©÷–Θ§ΑΉΝΉ≤Μ»Φ…’ΓΘ ≤Ϋ÷η3œρAΤΩ÷–Φ”¬ζ80Γφ»»Υ°Θ§Κ°ΫτΤΩ»ϊΘ§ΑΉΝΉ≤Μ»Φ…’ΓΘ ≤Ϋ÷η4¥ρΩΣK1ΓΔK2Θ§¥”aΩΎœρAΤΩ÷–ΙΡ»κΩ’ΤχΘ§¥ΐΤΩ÷–ΒΡ“ΚΟφΒΆ”Ύ»Φ…’≥ΉΒΉ≤Ω ±Θ§ΙΊ±’K1ΓΔK2Θ°¥Υ ±Ϋχ»κΝΩΦρB÷–Υ°ΒΡΧεΜΐΈΣ100mLΘ§Ιέ≤λΒΫAΤΩ÷–ΒΡΑΉ»Φ…’ΓΘ |
Θ®1Θ©«κ–¥≥ωΑΉΝΉ»Φ…’ΒΡΜ·―ßΖΫ≥Χ Ϋ______ΓΘ
Θ®2Θ©Ε‘±»≤Ϋ÷η3ΚΆ4ΒΡœ÷œσΩ…÷ΣΘ§Ω…»ΦΈο»Φ…’ΒΡΧθΦΰ÷°“Μ «______ΓΘ
Θ®3Θ©¥ΐΉΑ÷Οά以“ΜΕΈ ±ΦδΚσΘ§¥ρΩΣK2Θ§»γΙϊΙέ≤λΒΫ______Θ§ΥΒΟςΩ’Τχ÷–―θΤχΒΡΧεΜΐ‘Φ’ΦΘ§ΒΪ Β―ι≤βΒΟΩ’Τχ÷–―θΤχΒΡΧεΜΐΖ÷ ΐ–Γ”ΎΘ§‘≠“ρΩ…Ρή «______Θ®¥π“ΜΧθΦ¥Ω…Θ©ΓΘ
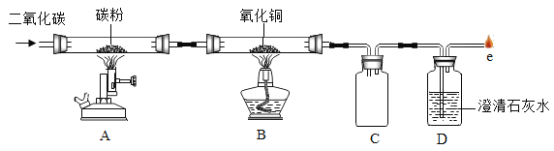
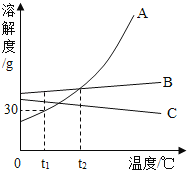
Θ®ΫΜΝςΘ©ΈΣΝΥΑο÷ζΆ§―ßΟ«ΗϋΚΟΒΊάμΫβΩ’Τχ÷–―θΤχΚ§ΝΩ≤βΕ®ΒΡ Β―ι‘≠άμΘ§άœ Πάϊ”Ο¥ΪΗ–ΤςΦΦ θ Β ±≤βΕ®ΝΥ Β―ιΉΑ÷ΟΡΎΒΡ―Ι«ΩΓΔΈ¬Ε»ΚΆ―θΤχ≈®Ε»Θ§»ΐΧθ«ζœΏ±δΜ·«ς Τ»γΆΦΥυ ΨΓΘ
Θ®4Θ©Τδ÷–Y«ζœΏ±μ ΨΒΡ «______Θ®ΧνΓΑΈ¬Ε»Γ±ΜρΓΑ―θΤχΒΡ≈®Ε»Γ±Θ©ΓΘ
Θ®Ζ¥ΥΦΘ©
Θ®5Θ©Ϋβ Ά―Ι«Ω«ζœΏBCΕΈ±δΜ·ΒΡ‘≠“ρ «______ΘΜDEΕΈ±δΜ·ΒΡ‘≠“ρ «______ΓΘ