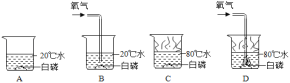
题目内容
【题目】在工业上用纯碱和石灰石为原料制备氢氧化钠,主要流程如图所示:
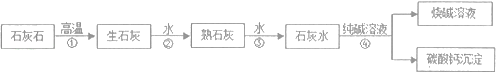
(1)在上述四个过程中,发生了复分解反应的是_____(填①、②、③、④之一)。
(2)在上述四个过程中,属于化合反应的化学方程式为_____。
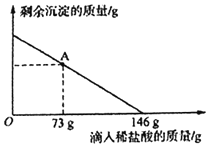
(3)在室温下,将212g溶质质量分数为10%的碳酸钠溶液与一定量澄清石灰水充分混合,恰好完全反应。试通过计算,求所得溶液中氢氧化钠的质量。_____。
【答案】④。 CaO+H2O=Ca(OH)2。 16g。
【解析】
整个转化过程为:
①CaCO3![]() CaO+CO2↑,分解反应;
CaO+CO2↑,分解反应;
②CaO+H2O=Ca(OH)2,化合反应;
③为溶液配制,物理变化;
④Na2CO3+Ca(OH)Cl2═CaCO3↓+2NaOH,为复分解反应。
故可得:
(1)在上述四个过程中,发生了复分解反应的是 ④。
(2)在上述四个过程中,属于化合反应的化学方程式为 CaO+H2O=Ca(OH)2。
(3)碳酸钠的质量为212g×10%=21.2g
设所得溶液中氢氧化钠的质量为x

![]()
x=16g

练习册系列答案
相关题目