题目内容
【题目】某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数。
(查阅资料)
①氢氧化镁和氢氧化铝均难溶于水。难溶性碱受热后能分解生成水和相应的金属氧化物。
②镁和氢氧化镁均不能与氢氧化钠溶液反应,但铝和氢氧化铝分别能与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al(OH)3+NaOH=NaAlO2+2H2O.氯化铝可与过量氢氧化钠溶液发生反应AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。
(方案设计)
他们利用实验室提供的盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:![]()
方案二:![]()
方案三:![]()
(方案评价)
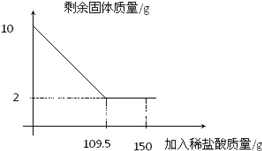
(1)方案三中最后的灼烧产物的主要成分为水和______(用化学式表示)
(2)小段认为三个方案理论上均可行,但方案三不如其他方案,理由是______。
(实验设计)
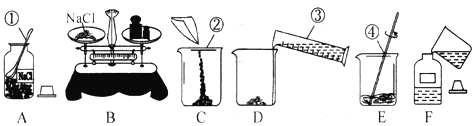
实验小组根据方案二设计了如图所示(图中的铁架台已省略)的实验装置。
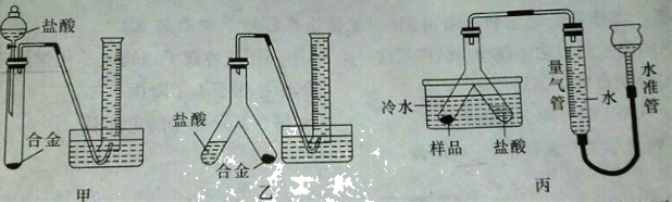
(3)你认为选择装置______(填“甲”或“乙”)测定镁的质量分数更合理,误差更小,理由是______。
(4)若装置丙中不使用冷水,则所测得气体的体积会______(填“偏大”“偏小”或“不变”)。
(交流讨论)
(5)实验小组成员通过交流讨论后重新设计了方案:①称取铝镁合金质量;②加入足量的______;③过滤④洗涤;⑤干燥;⑥称取剩余固体的总质量。
【答案】MgO 操作复杂 乙 甲中滴加的盐酸占据一定的体积 偏大 氢氧化钠溶液
【解析】
(1)方案三中最后的灼烧产物的主要成分为氢氧化镁受热分解生成的水和氧化镁。故填:MgO。
(2)小段认为三个方案理论上均可行,但方案三不如其他方案,通过比较可知,操作三操作比其他方案更为复杂,。故填:操作复杂。
(3)通过比较可知,甲中滴加的盐酸占据一定的体积,导致测定的气体体积偏大,因此选择装置乙测定镁的质量分数更合理,误差更小;故填:乙;甲中滴加的盐酸占据一定的体积。
(4)由于金属和盐酸反应放热,若装置丙中不使用冷水,温度升高会导致气体膨胀,则所测得气体的体积会偏大。故填:偏大。
(5)除了三种方案外,还可以采取的方法是把镁铝合金中的铝用氢氧化钠反应掉,剩余的就是镁了,直接称量镁的质量即可。因此可以重新设计了如下方案:①称取铝镁合金质量;②加入足量的氢氧化钠溶液;③过滤④洗涤;⑤干燥;⑥称取剩余固体的总质量(镁的质量)。故填:氢氧化钠溶液。

 期末集结号系列答案
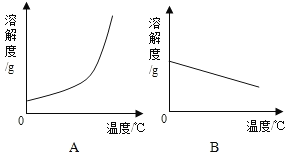
期末集结号系列答案【题目】下表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | ||||||
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,图中能表示NaOH溶解度曲线的是_____(填“A”或“B”).
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可采取措施有_____(填序号).
①蒸发水 ②升高温度 ③降低温度 ④加入水 ⑤加入氢氧化钙
(3)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____.
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20℃,得到乙溶液,溶液中溶质的质量分数的关系为甲_____乙(填“>”“<”或“=”).