题目内容
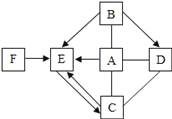
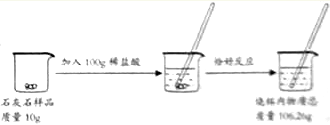
【题目】鸡蛋壳的主要成分是碳酸钙,其余为杂质,(杂质不溶于水且不参加反应)为了测定蛋壳中碳酸钙的质量分数。小东和小明同学进行了如下实验,相关实验数据如下图所示:

(1)小东根据“蛋壳残渣质量为4.3克”,求得蛋壳中碳酸钙的质量分数为_________;
(2)小明根据“反应过程中减少的质量”(10克+100克-106.7克=3.3克)也求得了蛋壳中碳酸钙的质量分数,请你写出小明的计算过程和结果__________________。
(3)小东和小明经过反复实验得出该鸡蛋壳中碳酸钙的质量分数与小明结果吻合,请分析小东开始所得结果出现误差的原因是__________________________。
【答案】 57% 75% 小东计算所用的蛋壳残渣未干燥
【解析】(1)小东根据“蛋壳残渣质量为4.3克”,求得蛋壳中碳酸钙的质量分数为(10g-4.3g)÷10g×100%=57%;(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,所以生成二氧化碳的质量=参加反应前各物质的质量总和反应后剩余各物质的质量总和;生成二氧化碳的质量为:10g+100g-106.7g=3.3g;
设:碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
10044
x3.3g
100/x=44/3.3g x=7.5g,
蛋壳中碳酸钙的质量分数: 7.5g÷10g×100%=75%;
(3)小东开始所得结果出现误差的原因是小东计算所用的蛋壳残渣未干燥。使滤渣的质量偏高。

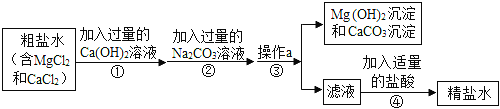
【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
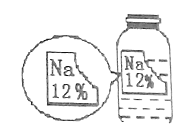
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
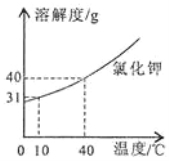
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
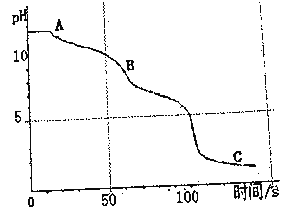
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。